题目内容
11.25℃时,水中存在电离平衡:H2O?H++OH-,下列关于水的说法正确的是( )| A. | 水的电离是吸热过程,升高温度不利于电离 | |
| B. | 向水中加入少量稀硫酸,水的离子积KW不变 | |
| C. | 含H+的溶液显酸性,含OH-的溶液显碱性 | |
| D. | 向水中加入少量氢氧化钠溶液,水的电离程度变大 |
分析 A.水的电离是吸热反应,升高温度促进电离;
B.离子键常数只与温度有关;
C.任何电解质溶液中都存在H+、OH-;
D.酸或碱抑制水电离,含有弱离子的盐促进水电离.
解答 解:A.水的电离是吸热反应,升高温度平衡向吸热反应方向移动,所以促进电离,故A错误;
B.离子键常数只与温度有关,与溶液酸碱性无关,温度不变,水的离子积常数不变,故B正确;
C.任何电解质溶液中都存在H+、OH-,根据c(H+)、c(OH-)对大小确定溶液酸碱性,故C错误;
D.酸或碱抑制水电离,含有弱离子的盐促进水电离,NaOH在水溶液中电离出氢氧根离子而抑制水电离,故D错误;
故选B.
点评 本题以离子积常数为载体考查水的电离,离子积常数只与温度有关,与溶液酸碱性及溶液浓度无关,注意:化学平衡常数、电离平衡常数、盐类水解平衡常数、溶度积常数等都只与温度有关,题目难度不大.

练习册系列答案
 名题金卷系列答案
名题金卷系列答案
相关题目
11.全部由第三周期元素形成的化合物是( )
| A. | HF | B. | NO | C. | Na2S | D. | MgF2 |
9.用NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 用石墨作电极电解饱和食盐水时,若阴极得到2NA个电子,则阳极产生22.4L气体 | |
| B. | 常温常压下,Na2O2与足量H2O反应,共生成0.2mol O2,转移的电子数目是0.8NA | |
| C. | 1L 1mol/L的K2CO3溶液中离子总数小于3NA | |
| D. | 室温下,42.0g 乙烯和丙烯的混合气体中含有的碳原子数为3NA |
6.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
| A. | 电解饱和食盐水时,阴极的电极反应式为:2Cl--2e-═Cl2↑ | |
| B. | 在镀件上电镀铜时可用镀件作阳极,电极反应式为:Cu2++2e-═Cu | |
| C. | 粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-═Cu2+ | |
| D. | 钢铁发生吸氧腐蚀时,正极反应式为:O2+2H2O+4e-═4OH- |
16.用下列实验装置能达到所述的实验目的是( )
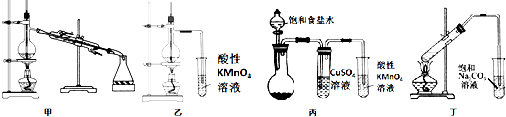

| A. | 利用装置甲既可以进行石油的分馏,也可以进行酒精的浓缩 | |
| B. | 利用装置乙可以完成实验室制备乙烯气体并检验乙烯气体的生成 | |
| C. | 利用装置丙可以完成实验室制备乙炔气体并检验乙炔气体的生成 | |
| D. | 利用装置丁可以完成实验室制备乙酸乙酯并收集较为纯净的乙酸乙酯 |
3.以下四种有机物的分子式皆为C4H10O:
①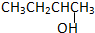 ②CH3CH2CH2CH2OH③
②CH3CH2CH2CH2OH③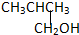 ④
④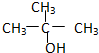
其中能氧化成醛的是( )
①
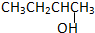 ②CH3CH2CH2CH2OH③
②CH3CH2CH2CH2OH③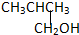 ④
④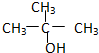
其中能氧化成醛的是( )
| A. | ①② | B. | 只有② | C. | ②和③ | D. | ③和④ |
20.机物A的结构如图所示,下列说法正确的是( )
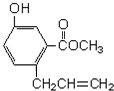

| A. | 一定条件下和浓溴水反应时,1mol A能消耗3molBr2 | |
| B. | 一定条件下,1mol A能和5mol氢气发生加成反应 | |
| C. | 一定条件下,1mol A能与3molNaOH反应 | |
| D. | A能与碳酸氢钠溶液反应 |
1.Ca(OH)2溶解度随温度变化曲线如图,下列说法错误的是( )


| A. | a点溶液升高温度后会出现浑浊 | |
| B. | 30℃时Ca(OH)2溶液的浓度一定大于60℃时的浓度 | |
| C. | 30℃时Ca(OH)2的Ksp约等于3.2×10-5 | |
| D. | 若在a点溶液中加入CaO溶液中溶质质量将减少 |