题目内容
12.下列有关化学用语表示正确的是( )| A. | 乙炔的结构简式:C2H2 | |
| B. | S2-的结构示意图: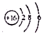 | |
| C. | 甲烷分子的球棍模型 | |
| D. | 硫酸钠的电离方程式:Na2S04=2Na++S042- |
分析 A.结构简式碳碳三键不能省略;
B.S2-的质子数为16,核外电子数为18,各层电子数分别为2、8、8,用小圈和圈内的数字表示原子核和核内质子数,弧线表示电子层,弧线上的数字表示该层的电子数;
C.甲烷分子式为CH4,C原子形成4个C-H,为正四面体结构,图示为比例模型;
D.硫酸钠为强电解质,完全电离生成钠离子和硫酸根离子.
解答 解:A.乙炔的结构简式CH≡CH,故A错误;
B.S2-的质子数为16,核外电子数为18,各层电子数分别为2、8、8,硫离子结构示意图为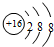 ,故B错误;
,故B错误;
C.球棍模型表现原子间的连接与空间结构,图示为比例模型,甲烷分子式为CH4,C原子形成4个C-H,为正四面体结构,碳原子半径大于氢原子半径,球棍模型为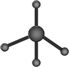 ,故C错误;
,故C错误;
D.硫酸钠为强电解质,完全电离生成钠离子和硫酸根离子,电离方程式为:Na2SO4=2Na++SO42-,故D正确;
故选D.
点评 本题考查了常见化学用语的书写判断,题目难度不大,注意掌握结构简式、原子结构示意图、球棍模型、电离方程式等化学用语的书写原则,明确球棍模型与比例模型的区别,试题培养了学生规范答题的能力.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案
相关题目
3.以下四种有机物的分子式皆为C4H10O:
①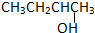 ②CH3CH2CH2CH2OH③
②CH3CH2CH2CH2OH③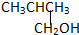 ④
④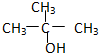
其中能氧化成醛的是( )
①
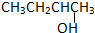 ②CH3CH2CH2CH2OH③
②CH3CH2CH2CH2OH③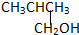 ④
④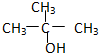
其中能氧化成醛的是( )
| A. | ①② | B. | 只有② | C. | ②和③ | D. | ③和④ |
20.机物A的结构如图所示,下列说法正确的是( )


| A. | 一定条件下和浓溴水反应时,1mol A能消耗3molBr2 | |
| B. | 一定条件下,1mol A能和5mol氢气发生加成反应 | |
| C. | 一定条件下,1mol A能与3molNaOH反应 | |
| D. | A能与碳酸氢钠溶液反应 |
7.将铝粉逐渐投入饱和氯化铁的黄色溶液中,首先看到溶液变成红褐色,并产生气泡;后来有少量的红褐色沉淀,并有少量的能被磁铁吸引的黑色沉淀物质生成.下列叙述不正确的是( )
| A. | 红褐色溶液物质是Fe(OH)3胶体,气泡的成分是H2 | |
| B. | 红褐色沉淀是Fe(OH)3沉淀,黑色的物质是Fe | |
| C. | 除去红褐色溶液中少量沉淀的实验方法是参析 | |
| D. | 由于Fe3+在溶液中被水分子包围形成[Fe(H2O)4]3+,不利于铝粉与Fe3+的接触反应,所以只生成少量的单质铁 |
17.设NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 28g乙烯的气体中含有H原子数为2NA | |
| B. | 标准状况下,2.24L乙醇与足量Na反应生成H2分子数0.05NA | |
| C. | 每摩尔-OH中含电子数目为9NA | |
| D. | 每摩尔苯中含有的碳碳双键的数目为3NA |
4.元素周期表是元素周期律的具体表现形式.下列说法正确的是( )
| A. | 第二周期元素的最高正价从左向右依次从+1递增到+7价 | |
| B. | 同一周期从左到右,元素的金属性逐渐增强、非金属性逐渐减弱 | |
| C. | 第IA元素全部是金属元素 | |
| D. | 可在金属与非金属分界线附近寻找半导体材料 |
1.Ca(OH)2溶解度随温度变化曲线如图,下列说法错误的是( )


| A. | a点溶液升高温度后会出现浑浊 | |
| B. | 30℃时Ca(OH)2溶液的浓度一定大于60℃时的浓度 | |
| C. | 30℃时Ca(OH)2的Ksp约等于3.2×10-5 | |
| D. | 若在a点溶液中加入CaO溶液中溶质质量将减少 |
2.下列说法正确的是( )
| A. | 将FeCl3饱和溶液煮沸可得到带正电荷的Fe(OH)3胶体 | |
| B. | 光导纤维具有很强的导电能力,所以大量用于制造通信光缆 | |
| C. | 硅酸钠溶液可以用作黏合剂,不能用作防火材料 | |
| D. | CaO和HCl的水溶液均能导电,且它们都属于电解质 |