题目内容
5.下列反应的离子方程式正确的是( )| A. | Fe与稀H2SO4反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| C. | 氧化铜溶于硫酸:O2-+2H+═H2O | |
| D. | NaCl溶液与AgNO3溶液反应:Ag++Cl-═AgCl↓ |
分析 A.反应生成硫酸亚铁和氢气;
B.漏写生成氢氧化铜的离子反应;
C.CuO在离子反应中保留化学式;
D.反应生成氯化银沉淀和硝酸钠.
解答 解:A.Fe与稀H2SO4反应的离子反应为Fe+2H+═Fe2++H2↑,故A错误;
B.硫酸铜溶液与氢氧化钡溶液反应的离子反应为Cu2++2OH-+Ba2++SO42-═BaSO4↓+Cu(OH)2↓,故B错误;
C.氧化铜溶于硫酸的离子反应为CuO+2H+═H2O+Cu2+,故C错误;
D.NaCl溶液与AgNO3溶液反应的离子反应为Ag++Cl-═AgCl↓,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应的离子反应考查,注意离子反应中保留化学式的物质,题目难度不大.

练习册系列答案
相关题目
18.硅孔雀石的主要成分为CuCO3•Cu(OH)2和CuSiO3•2H2O,还含有SiO2、FeCO3、Fe2O3、Al2O3等杂质.以硅孔雀石为原料制取硫酸铜的工艺流程如下:
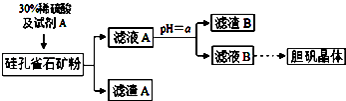
部分氢氧化物开始沉淀和完全沉淀的pH如下表
请回答下列问题:
(1)滤渣B的主要成分是Fe(OH)3、Al(OH)3(用化学式表示);判断本实验能否调节溶液pH使杂质完全除去而不损失Cu2+,并简述理由否,铝离子全部沉淀时铜离子有沉淀
(2)用离子方程式表示加入绿色氧化剂A的作用2Fe2++H2O2+2H+═2Fe3++2H2O
(3)可向滤液A中加入bd(填字母)调节PH以除去杂质
a.氨水 b.氧化铜 c.氢氧化钠 d.氢氧化铜
(4)从滤液B中提取胆矾的操作包括蒸发浓缩、冷却结晶、过滤、用乙醇洗涤、用滤纸吸干等
(5)测定产品纯度和胆矾中结晶水数目
①沉淀法测定产品纯度
取一定质量的样品溶于蒸馏水,加入足量的BaCl2溶液和稀硝酸,过滤、洗涤、干燥、称重,实验结果发现测得的产品纯度偏高,可能的原因是acd填字母)
a.产品失去部分结晶水 b.产品中混有CuCl2•2H2O
c.产品中混有Al2(SO4)3•12H2O d.产品中混有Na2SO4
②差量法测得结晶水数目
取ag样品盛装在干燥的坩锅里,灼烧至结晶水全部失去,称得无水硫酸铜的质量b g,则胆矾(CuSO4•nH2O)中n值的表达式为$\frac{80(a-b)}{9b}$.

部分氢氧化物开始沉淀和完全沉淀的pH如下表
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
| 完全沉淀的pH | 5.2 | 3.7 | 9.7 | 6.7 |
(1)滤渣B的主要成分是Fe(OH)3、Al(OH)3(用化学式表示);判断本实验能否调节溶液pH使杂质完全除去而不损失Cu2+,并简述理由否,铝离子全部沉淀时铜离子有沉淀
(2)用离子方程式表示加入绿色氧化剂A的作用2Fe2++H2O2+2H+═2Fe3++2H2O
(3)可向滤液A中加入bd(填字母)调节PH以除去杂质
a.氨水 b.氧化铜 c.氢氧化钠 d.氢氧化铜
(4)从滤液B中提取胆矾的操作包括蒸发浓缩、冷却结晶、过滤、用乙醇洗涤、用滤纸吸干等
(5)测定产品纯度和胆矾中结晶水数目
①沉淀法测定产品纯度
取一定质量的样品溶于蒸馏水,加入足量的BaCl2溶液和稀硝酸,过滤、洗涤、干燥、称重,实验结果发现测得的产品纯度偏高,可能的原因是acd填字母)
a.产品失去部分结晶水 b.产品中混有CuCl2•2H2O
c.产品中混有Al2(SO4)3•12H2O d.产品中混有Na2SO4
②差量法测得结晶水数目
取ag样品盛装在干燥的坩锅里,灼烧至结晶水全部失去,称得无水硫酸铜的质量b g,则胆矾(CuSO4•nH2O)中n值的表达式为$\frac{80(a-b)}{9b}$.
15.我国新一代气象卫星“风云三号”于今年5月27日成功发射,运载火箭的主要燃料是偏二甲肼(用R表示),其燃烧的化学方程式为:R+2N2O4=3N2+4H2O+2CO2.则R的化学式是( )
| A. | C2H8N2 | B. | N2H4 | C. | CH4 | D. | C6H7N |
 有剧毒
有剧毒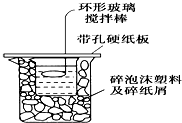 50mL 0.50mol/L的盐酸和50mL 0.55mol/L的烧碱溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热,试回答下列问题:
50mL 0.50mol/L的盐酸和50mL 0.55mol/L的烧碱溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热,试回答下列问题: