题目内容
17.如图1是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.现用该浓硫酸配制100mL 1mol•L-1的稀硫酸.可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;
④药匙;⑤量筒;⑥托盘天平.请回答下列问题:

(1)如图2盛放浓硫酸的试剂瓶标签上应印有下列警示标记中的D
(2)配制稀硫酸时,还缺少的仪器有玻璃棒和100mL的容量瓶(写仪器名称);
(3)经计算,配制100mL1mol•L-1的稀硫酸需要用量筒量取上述浓硫酸的体积为5.4mL,量取硫酸时应选用AmL规格的量筒;
A.10mL B.50mL C.100mL D.200mL
(4)在烧杯中稀释浓硫酸的实验操作为将浓硫酸沿烧杯壁缓缓注入装有水的烧杯中,并用玻璃棒不断搅拌,使产生的热迅速散去,若在稀释过程中,少量浓硫酸不慎沾在手上,处理方法为先用抹布抹去,然后用大量水冲洗,再涂上NaHCO3的稀溶液.
(5)对所配制的稀硫酸进行测定,发现其浓度大于1mol•L-1,配制过程中下列各项操作可能引起该误差的原因ACE.
A.用量筒量取浓硫酸时,仰视刻度线取浓硫酸
B.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水
C.将稀释后的稀硫酸立即转入容量瓶后,紧接着就进行以后的实验操作
D.转移溶液时,不慎有少量溶液洒到容量瓶外面
E.定容时,俯视容量瓶刻度线进行定容
F.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处.
分析 (1)浓硫酸是强酸,有很强的腐蚀性;
(2)根据配制步骤是计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶来分析需要的仪器;
(3)先计算出浓硫酸的物质的量浓度为c=$\frac{1000ρω}{M}$,然后根据溶液稀释定律C浓V浓=C稀V稀来计算;根据“大而近”的原则,根据需要量取的浓硫酸的体积来选择合适的量筒;
(4)根据浓硫酸溶于水放热来分析稀释操作;由于浓硫酸稀释放热,故当浓硫酸沾到手上时,不要直接用水冲,据此分析;
(5)根据c=$\frac{n}{V}$并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析;
解答 解:(1)浓硫酸是强酸,有很强的腐蚀性,故应贴腐蚀品标志,故选D;
(2)根据配制步骤是计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶可知所需的仪器有量筒、烧杯、玻璃棒、100mL容量瓶和胶头滴管,故还缺少的仪器为:玻璃棒和100mL的容量瓶,故答案为:玻璃棒和100mL的容量瓶;
(3)浓硫酸的物质的量浓度为c=$\frac{1000ρω}{M}$=$\frac{1000×1.84×98%}{98}$=18.4mol/L,设所需浓硫酸的体积为VmL,根据溶液稀释定律C浓V浓=C稀V稀可知:18.4mol/L×VmL=1mol/L×100mL
解得V=5.4mL;根据“大而近”的原则,根据需要量取的浓硫酸的体积为5.4mL,可知应选择合适10mL的量筒,故答案为:5.4,A;
(4)由于浓硫酸溶于水放热,故稀释时应将浓硫酸沿烧杯壁缓缓注入装有水的烧杯中,并用玻璃棒不断搅拌,使产生的热迅速散去;由于浓硫酸稀释放热,故当浓硫酸沾到手上时,不要直接用水冲,应先用抹布抹去,然后用大量水冲洗,再涂上NaHCO3的稀溶液;故答案为:将浓硫酸沿烧杯壁缓缓注入装有水的烧杯中,并用玻璃棒不断搅拌,使产生的热迅速散去;先用抹布抹去,然后用大量水冲洗,再涂上NaHCO3的稀溶液;
(5)A.用量筒量取浓硫酸时,仰视刻度线取浓硫酸,则所量取的溶液体积偏大,浓度偏高,故A正确;
B.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水,对所配溶液的浓度无影响,故B错误;
C.将稀释后的稀硫酸立即转入容量瓶后,紧接着就进行以后的实验操作,待冷却后溶液体积偏小,则浓度偏高,故C正确;
D.转移溶液时,不慎有少量溶液洒到容量瓶外面,则导致溶质损失,则浓度偏低,故D错误;
E.定容时,俯视容量瓶刻度线进行定容,则溶液体积偏小,浓度偏高,故E正确;
F.定容后,把容量瓶倒置摇匀后发现液面低于刻度线是正常的,便补充几滴水至刻度处,则浓度偏小,故F错误.
故选ACE.
点评 本题考查较为综合,涉及浓硫酸的性质以及溶液的配制,侧重于学生的分析能力和实验能力的考查,难度不大,注意相关基础知识的积累.

 阅读快车系列答案
阅读快车系列答案
pH值控制可参考下列数据
| 物 质 | 开始沉淀时的pH值 | 完全沉淀时的pH值 |
| 氢氧化铁 | 2.7 | 3.7 |
| 氢氧化亚铁 | 7.6 | 9.6 |
| 氢氧化铜 | 5.2 | 6.4 |
(1)A物质可选用b(填字母).
a.稀H2SO4b.浓H2SO4/△c.浓FeCl3溶液 d.浓HNO3
(2)Ⅰ中加H2O2的目的将Fe2+氧化为Fe3+.
(3)Ⅱ中加Cu2(OH)2CO3的目的是中和过量的硫酸,调节溶液的pH,使Fe3+水解完全而沉淀;其优点是不引入新的杂质.
(4)Ⅲ加热煮沸时发生的化学反应的离子方程式为Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3↓+3H+.
(5)V中加H2SO4调节pH=1是为了抑制Cu2+的水解.
(6)V到Ⅵ的操作是蒸发浓缩,冷却结晶,过滤
(7)某工程师认为上述流程中所加的A物质并不理想,需作改进,其理由是会产生SO2,会对污染环境,硫酸的利用率低.如何改进可以向稀硫酸中不断通氧气(或者加H2O2)并加热.
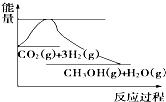 实现“节能减排”和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源.目前工业方法是用CO2来生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),下图表示该反应过程中能量(单位为kJ•mol-1)的变化:关于该反应的下列说法中,正确的是( )
实现“节能减排”和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源.目前工业方法是用CO2来生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),下图表示该反应过程中能量(单位为kJ•mol-1)的变化:关于该反应的下列说法中,正确的是( )| A. | △H<0,△S<0 | B. | △H>0,△S<0 | C. | △H>0,△S>0 | D. | △H<0,△S>0 |
| A. | Fe与稀H2SO4反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| C. | 氧化铜溶于硫酸:O2-+2H+═H2O | |
| D. | NaCl溶液与AgNO3溶液反应:Ag++Cl-═AgCl↓ |
①升温 ②恒容通入惰性气体 ③增加CO2的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体⑦增加Fe的物质的量,能提高CO2转化率的是( )
| A. | ①②⑦ | B. | ②③⑤ | C. | ①④⑥ | D. | ③⑤⑥ |
| A. | 六水氯化钙可用作食品干燥剂 | |
| B. | 生石灰作干燥剂是物理变化 | |
| C. | 为改善食物的色、香、味并防止变质,可在其中加入大量食品添加剂 | |
| D. | “血液透析”利用了胶体的性质 |
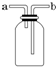 如图所示装置是化学实验室中的常用装置,它有多种用途,以下各项用途和操作都正确的是C(填序号).
如图所示装置是化学实验室中的常用装置,它有多种用途,以下各项用途和操作都正确的是C(填序号).