题目内容
14.在一定条件下,Fe2O3+3CO═2Fe+3CO2反应中,三氧化二铁(填名称)是氧化剂,CO(填化学式)发生氧化反应,C(填元素符号)元素被氧化,生成42g Fe时转移的电子的物质的量是2.25mol.分析 反应Fe2O3+3CO=2Fe+3CO2中,Fe元素化合价由+3价降低到0价,C元素化合价由+2价升高到+4价,结合化合价的变化解答该题.
解答 解:反应Fe2O3+3CO=2Fe+3CO2中,Fe元素化合价由+3价降低到0价,被还原,Fe2O3为氧化剂,C元素化合价由+2价升高到+4价,被氧化,CO为还原剂,
n(Fe)=$\frac{42g}{56g/mol}$=0.75mol,反应中Fe元素化合价由+3价降低到0价,则转移电子的物质的量为0.75mol×3=2.25mol,
故答案为:三氧化二铁;CO;C;2.25.
点评 本题考查氧化还原反应,为高频考点,侧重于学生的分析能力的考查,注意把握元素化合价的变化,为解答该题的关键,难度不大.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
5.下列反应的离子方程式正确的是( )
| A. | Fe与稀H2SO4反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| C. | 氧化铜溶于硫酸:O2-+2H+═H2O | |
| D. | NaCl溶液与AgNO3溶液反应:Ag++Cl-═AgCl↓ |
2.化学与生产、生活密切相关.下列叙述正确的是( )
| A. | 六水氯化钙可用作食品干燥剂 | |
| B. | 生石灰作干燥剂是物理变化 | |
| C. | 为改善食物的色、香、味并防止变质,可在其中加入大量食品添加剂 | |
| D. | “血液透析”利用了胶体的性质 |
9.下列说法正确的是( )
①江河入海口三角洲的形成通常与胶体的性质有关
②“钡餐”中使用的硫酸钡是弱电解质
③冰和干冰既是纯净物又是化合物
④雾是气溶胶,在阳光下可观察到丁达尔现象
⑤某无色溶液中加入稀盐酸,产生的气体可使澄清石灰水变浑浊,则原溶液中一定含CO${\;}_{3}^{2-}$
⑥可用渗析法分离Fe(OH)3胶体和KCl溶液.
①江河入海口三角洲的形成通常与胶体的性质有关
②“钡餐”中使用的硫酸钡是弱电解质
③冰和干冰既是纯净物又是化合物
④雾是气溶胶,在阳光下可观察到丁达尔现象
⑤某无色溶液中加入稀盐酸,产生的气体可使澄清石灰水变浑浊,则原溶液中一定含CO${\;}_{3}^{2-}$
⑥可用渗析法分离Fe(OH)3胶体和KCl溶液.
| A. | ①③④⑤ | B. | ①③④⑥ | C. | ①③④⑤⑥ | D. | ①②③④⑤⑥ |
19.下列实验装置中能达到实验目的是( )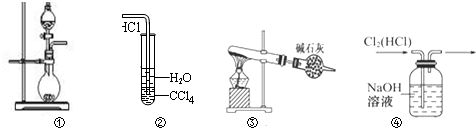

| A. | 图①可用于制取少量NH3或用MnO2和浓盐酸制取Cl2 | |
| B. | 装置②可用于氯化氢气体溶于水 | |
| C. | 以NH4Cl为原料,装置③可用于实验室制备少量干燥的NH3 | |
| D. | 装置④可用于除去Cl2中的HCl |
3.在指定环境中可能大量共存的离子组是( )
| A. | 在c(H+)=1.0×10-13mol•L-1的溶液中:Na+、S2-、AlO2-、SO32- | |
| B. | 在由水电离出的c(H+)=1×10-12mol/L的溶液中:Fe2+ NO3- Na+ SO42- | |
| C. | 使甲基橙变红的溶液中:NH4+、K+、ClO-、Cl- | |
| D. | 能与Al反应放出H2的溶液中:K+、Cu2+、Cl-、NO3- |
3.将溶液中的Mg2+、Al3+分离,可选用的试剂是( )
| A. | 氨水 | B. | NaOH | C. | NaOH和盐酸 | D. | K2CO3溶液 |

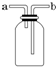 如图所示装置是化学实验室中的常用装置,它有多种用途,以下各项用途和操作都正确的是C(填序号).
如图所示装置是化学实验室中的常用装置,它有多种用途,以下各项用途和操作都正确的是C(填序号).