题目内容
石墨炸弹爆炸时能在方圆几百米范围内撒下大量石墨纤维,造成输电线、电厂设备损坏。这是由于石墨
A.有放射性 B易燃、易爆 C能导电 D 有剧毒
有剧毒
练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
10.胆矾是一种常见的化合物,工业上它也是一种制取其它含铜化合物的原料.现有废铜(主要杂质为Fe)来制备胆矾.有人设计了如下流程:

pH值控制可参考下列数据
请根据上述流程回答下列问题:
(1)A物质可选用b(填字母).
a.稀H2SO4b.浓H2SO4/△c.浓FeCl3溶液 d.浓HNO3
(2)Ⅰ中加H2O2的目的将Fe2+氧化为Fe3+.
(3)Ⅱ中加Cu2(OH)2CO3的目的是中和过量的硫酸,调节溶液的pH,使Fe3+水解完全而沉淀;其优点是不引入新的杂质.
(4)Ⅲ加热煮沸时发生的化学反应的离子方程式为Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3↓+3H+.
(5)V中加H2SO4调节pH=1是为了抑制Cu2+的水解.
(6)V到Ⅵ的操作是蒸发浓缩,冷却结晶,过滤
(7)某工程师认为上述流程中所加的A物质并不理想,需作改进,其理由是会产生SO2,会对污染环境,硫酸的利用率低.如何改进可以向稀硫酸中不断通氧气(或者加H2O2)并加热.

pH值控制可参考下列数据
| 物 质 | 开始沉淀时的pH值 | 完全沉淀时的pH值 |
| 氢氧化铁 | 2.7 | 3.7 |
| 氢氧化亚铁 | 7.6 | 9.6 |
| 氢氧化铜 | 5.2 | 6.4 |
(1)A物质可选用b(填字母).
a.稀H2SO4b.浓H2SO4/△c.浓FeCl3溶液 d.浓HNO3
(2)Ⅰ中加H2O2的目的将Fe2+氧化为Fe3+.
(3)Ⅱ中加Cu2(OH)2CO3的目的是中和过量的硫酸,调节溶液的pH,使Fe3+水解完全而沉淀;其优点是不引入新的杂质.
(4)Ⅲ加热煮沸时发生的化学反应的离子方程式为Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3↓+3H+.
(5)V中加H2SO4调节pH=1是为了抑制Cu2+的水解.
(6)V到Ⅵ的操作是蒸发浓缩,冷却结晶,过滤
(7)某工程师认为上述流程中所加的A物质并不理想,需作改进,其理由是会产生SO2,会对污染环境,硫酸的利用率低.如何改进可以向稀硫酸中不断通氧气(或者加H2O2)并加热.
8.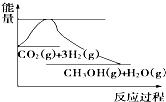 实现“节能减排”和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源.目前工业方法是用CO2来生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),下图表示该反应过程中能量(单位为kJ•mol-1)的变化:关于该反应的下列说法中,正确的是( )
实现“节能减排”和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源.目前工业方法是用CO2来生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),下图表示该反应过程中能量(单位为kJ•mol-1)的变化:关于该反应的下列说法中,正确的是( )
 实现“节能减排”和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源.目前工业方法是用CO2来生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),下图表示该反应过程中能量(单位为kJ•mol-1)的变化:关于该反应的下列说法中,正确的是( )
实现“节能减排”和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源.目前工业方法是用CO2来生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),下图表示该反应过程中能量(单位为kJ•mol-1)的变化:关于该反应的下列说法中,正确的是( )| A. | △H<0,△S<0 | B. | △H>0,△S<0 | C. | △H>0,△S>0 | D. | △H<0,△S>0 |
5.下列反应的离子方程式正确的是( )
| A. | Fe与稀H2SO4反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| C. | 氧化铜溶于硫酸:O2-+2H+═H2O | |
| D. | NaCl溶液与AgNO3溶液反应:Ag++Cl-═AgCl↓ |





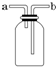 如图所示装置是化学实验室中的常用装置,它有多种用途,以下各项用途和操作都正确的是C(填序号).
如图所示装置是化学实验室中的常用装置,它有多种用途,以下各项用途和操作都正确的是C(填序号).