题目内容
10.①铁片;②饱和食盐水;③液态的纯硫酸(不含水);④蔗糖;⑤干冰;⑥熔融硝酸钾;⑦氢氧化钠固体.用序号回答:(1)其中属于电解质的是③⑥⑦(填序号,下同),
(2)属于非电解质的是④⑤
(3)可导电的是①②⑥.
分析 电解质是在水溶液里或熔融状态下能导电的化合物;非电解质是在水溶液里和熔融状态下都不能导电的化合物;能导电的物质必须有自由电子或自由移动的离子,据此解答.
解答 解:①铁片是单质,既不是电解质也不是非电解质,但有自由电子,所以能导电;
②饱和食盐水是混合物,既不是电解质也不是非电解质,但有自由移动的离子,所以能导电;
③液态的纯硫酸(不含水)在水溶液里能够导电,属于电解质,但是不含自由电子或自由移动的离子,不导电;
④蔗糖在水溶液里和熔融状态下都不能导电,属于非电解质,不含自由电子或自由移动的离子,不导电;
⑤干冰本身不能电离,属于非电解质,不含自由电子或自由移动的离子,不导电;
⑥熔融硝酸钾熔融状态下能导电,属于电解质,有自由移动的离子,所以能导电;
⑦氢氧化钠固体在水溶液里或熔融状态下能导电,属于电解质,不含自由电子或自由移动的离子,不导电;
所以(1)其中属于电解质的是:③⑥⑦;
(2)属于非电解质的是:④⑤;
(3)可导电的是:①②⑥;
故答案为:③⑥⑦;④⑤;①②⑥.
点评 本题考查了电解质和非电解质的概念,以及电解质和金属导电的问题,熟悉相关概念是解题关键,注意单质、混合物既不是电解质也不是非电解质,题目难度不大.

练习册系列答案
 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
18.某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中P表示压强,T表示温度,n表示物质的量):根据以上规律判断,上列结论正确的是( )
| A. | 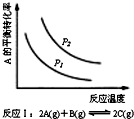 反应Ⅰ:△H>0,P2>P1 | B. | 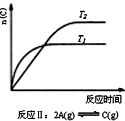 反应Ⅱ:△H<0,T1<T2 | ||
| C. | 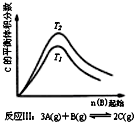 反应Ⅲ:△H<0,T2>T1;或△H>0,T2<T1 | D. | 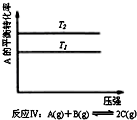 反应Ⅳ:△H<0,T2<T1或△H>0,T2>T1 |
5.下列反应的离子方程式正确的是( )
| A. | Fe与稀H2SO4反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| C. | 氧化铜溶于硫酸:O2-+2H+═H2O | |
| D. | NaCl溶液与AgNO3溶液反应:Ag++Cl-═AgCl↓ |
15.对下列装置或操作描述正确的是( )


| A. | 图①用于实验室制乙烯 | |
| B. | 图②用于实验室制乙炔并验证乙炔可以发生氧化反应 | |
| C. | 图③用于实验室中分馏石油 | |
| D. | 图④中若A为醋酸,B为贝壳,C为苯酚钠溶液,则可验证醋酸的酸性大于碳酸,但不能验证碳酸的酸性大于苯酚 |
2.化学与生产、生活密切相关.下列叙述正确的是( )
| A. | 六水氯化钙可用作食品干燥剂 | |
| B. | 生石灰作干燥剂是物理变化 | |
| C. | 为改善食物的色、香、味并防止变质,可在其中加入大量食品添加剂 | |
| D. | “血液透析”利用了胶体的性质 |
19.下列实验装置中能达到实验目的是( )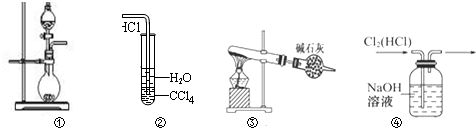

| A. | 图①可用于制取少量NH3或用MnO2和浓盐酸制取Cl2 | |
| B. | 装置②可用于氯化氢气体溶于水 | |
| C. | 以NH4Cl为原料,装置③可用于实验室制备少量干燥的NH3 | |
| D. | 装置④可用于除去Cl2中的HCl |


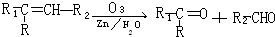 ,现有化学式为C10H20的烯烃,它经臭氧氧化后在Zn存在下水解只生成一种有机物.符合该条件的结构共有( )
,现有化学式为C10H20的烯烃,它经臭氧氧化后在Zn存在下水解只生成一种有机物.符合该条件的结构共有( )