题目内容
10.下列说法中正确的是( )| A. | 升高温度,活化分子百分数增大,化学反应速率加快 | |
| B. | CO2、NH3的水溶液能导电,所以CO2、NH3是电解质 | |
| C. | 干冰升华这一过程中,△S<0 | |
| D. | Na2SO4溶液的导电能力一定比CH3COOH溶液强 |
分析 A.升高温度后,反应物能量升高,增大了活化分子百分数;
B.二氧化碳和氨气的水溶液中的导电离子不是二者自身电离的,所以属于非电解质;
C.干冰升华过程中混乱度增大,则△S>0;
D.溶液导电性与溶液中离子浓度大小有关,与强弱电解质没有必然关系.
解答 解:A.升高温度能使化学反应速率增大的主要原因是增加了反应物分子中活化分子的百分数,故A正确;
B.CO2、NH3的水溶液能导电,但是导电电子不是二者自身电离的,所以CO2、NH3是非电解质,故B错误;
C.干冰升华过程中,有固体变为气态,其混乱度增大,则△S>0,故C错误;
D.溶液导电性主要取决于溶液中离子浓度大小,所以硫酸钠溶液的导电性不一定大于醋酸,故D错误;
故选A.
点评 本题考查了电解质与非电解质的判断、焓变与熵变、溶液导电性、化学反应速率的影响因素等知识,题目难度中等,注意掌握强弱电解质的概念,明确影响溶液导电性的因素,试题知识点较多,充分考查学生灵活应用基础知识的能力.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
18.电子层数相同的三种元素X、Y、Z,它们最高价氧化物对应水化物的酸性由强到弱顺序为:HXO4>H2YO4>H3ZO4,下列判断不正确的是( )
| A. | 原子半径X>Y>Z | |
| B. | 气态氢化物稳定性X>Y>Z | |
| C. | 元素原子得电子能力由强到弱X>Y>Z | |
| D. | 单质与氢气反应由易到难X>Y>Z |
1.一定条件下存在反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H=-QkJ/mol.现有三个相同的2L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在 I中充入1molCO和1molH2O,在Ⅱ中充入1molCO2和1mol H2,在Ⅲ中充入2molCO和2molH2O,700℃条件下开始反应.达到平衡时,上述三个过程对应的能量变化值分别为Q1、Q2、Q3.下列说法正确的是( )
| A. | 2Q1=2Q2<Q3 | |
| B. | 容器Ⅰ中CO的百分含量比容器Ⅲ中CO的百分含量高 | |
| C. | 容器Ⅰ中反应的平衡常数比容器Ⅱ中反应的平衡常数小 | |
| D. | 容器Ⅰ中CO的转化率与容器Ⅱ中CO2的转化率之和等于1 |
19.霉酚酸酯(MMF)是器官移植中抑制细胞增殖最常用的药物,它在酸性溶液中能发生如下反应:
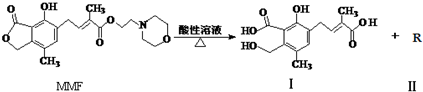
下列说法中正确的是( )

下列说法中正确的是( )
| A. | 1molMMF与足量NaOH 溶液共热,最多可消耗5molNaOH | |
| B. | 可以用NaHCO3溶液区别MMF与化合物Ⅰ | |
| C. | 化合物 R的分子式为C6H13NO2 | |
| D. | 一个MMF分子中含有2个手性碳原子 |
20.下列各组中,互为同素异形体的是( )
| A. | 12H2和13H2 | B. | H2O与H2O2 | C. | 金刚石和石墨 | D. | 碘晶体和碘蒸气 |
 2001年诺贝尔化学奖被美国的诺尔斯、夏普雷斯和日本的野依良治获得,他们发现了某些手性化子可用作某些化学反应的催化剂,为合成对人类有用的重要化合物开辟了一个全新的研究领域.
2001年诺贝尔化学奖被美国的诺尔斯、夏普雷斯和日本的野依良治获得,他们发现了某些手性化子可用作某些化学反应的催化剂,为合成对人类有用的重要化合物开辟了一个全新的研究领域. 、
、 .
. ②
② ③
③
 .
.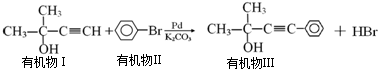

 则需要两种有机物的结构简式分别是HCHO和
则需要两种有机物的结构简式分别是HCHO和 或
或 和CH3MgBr
和CH3MgBr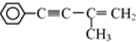 的反应方程式
的反应方程式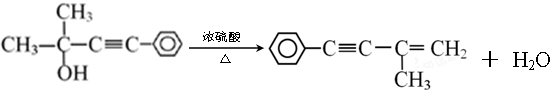
 CH3C≡CCH2OH+HI.
CH3C≡CCH2OH+HI. .
. 为了探究化学能和热能的转化,某实验小组设计了如下三套实验装置:
为了探究化学能和热能的转化,某实验小组设计了如下三套实验装置: