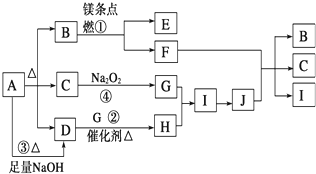
题目内容
6.将多少克钠投入10g水中,反应后生成的溶液在10℃时刚好饱和?此饱和溶液中溶质的质量分式是多少?(已知10℃时该溶液中溶质的溶解度为22g)分析 钠为金属活动性很强的金属,能与水反应生成氢氧化钠并放出氢气;因此,钠投入水中所得溶液为氢氧化钠溶液,由于钠能与水反应,所以所得溶液中溶剂水的质量可根据反应计算消耗掉水的质量而求得;根据该温度下的溶解度,判断所得饱和溶液溶质与溶剂的质量关系,利用反应的化学方程式计算反应生成氢氧化钠的质量;并利用饱和溶液的溶质质量分数与溶解度的关系:饱和溶液的溶质质量分数=$\frac{溶解度}{100g+溶解度}$×100%,计算此温度下饱和溶液的溶质质量分数.
解答 解:设反应生成氢氧化钠的质量为x
此时氢氧化钠的溶解度为22g,则所得饱和溶液中水的质量=$\frac{100x}{22}$g,参加反应的水的质量=10g-$\frac{100x}{22}$g;
2Na+2H2O=2NaOH+H2↑
36 80
10g-$\frac{100x}{22}$g x
$\frac{36}{10g-\frac{110x}{22}}=\frac{80}{x}$,解之得 x≈2g
设参加反应钠的质量为y
Na~NaOH
23 40
y 2g
$\frac{23}{y}=\frac{40}{2g}$,y≈1.2,此时饱和溶液的溶质质量分数=$\frac{22g}{100g+22g}$×100%≈18%
答:1.2g钠投入10克水中,反应后生成的溶液在10℃时刚好饱和;此饱和溶液中溶质的质量分数是18%.
点评 某温度下物质的溶解度为S,该温度下饱和溶液中溶质与溶剂的质量比为$\frac{S}{100}$;饱和溶液的溶质质量分数=$\frac{S}{100+S}$×100%,比较容易.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
16.下列叙述不正确的是( )
| A. | C2H4O和C3H6O均满足饱和一元醛的通式,因此它们一定互为同系物 | |
| B. | 乙烯和苯均可使溴水褪色,但是其褪色原理不同 | |
| C. | 乙烯和苯分子中各原子都在同一平面 | |
| D. | 检验乙烷中是否含有乙烯,试剂为酸性高锰酸钾溶液 |
17.下列反应的离子方程式正确的是( )
| A. | 苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| B. | FeSO4的酸性溶液中加H2O2:2Fe2++H2O2+2H+═2Fe3++2H2O | |
| C. | 用氨水吸收少量的SO2:NH3•H2O+SO2═NH4++HSO3- | |
| D. | 碳酸氢钠溶液中加入过量石灰水:HCO3-+OH-═CO32-+H2O |
14.运用化学知识解决生产、生活中的有关问题备受关注.请回答下列问题:
(1)已知水存在如下平衡:H2O?H++OH-△H>0,现欲使平衡向右移动,且所得溶液显碱性,选择方法是B.
A.向水中加入NaHSO4固体 B.向水中加Na2CO3固体
C.加热至100℃[其中c(H+)=1×10-6 mol•L-1]D.向水中加入NH4Cl固体
(2)常温下,浓度均为0.1mol•L-1的下列五种钠盐溶液的pH如下表;
上述盐溶液中的阴离子,结合H+能力最强的是CO32-,根据表中数据,浓度均
为0.01mol•L-1的下列四种酸的溶液分别稀释100倍,pH变化最大的是C(填编号).
A.HCN B.HClOC.CH3COOHD.H2CO3
(3)实验室中常用NaOH来进行洗气和提纯.当400mL 1mol•L-1的NaOH溶液吸收标准状况
下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为C(Na+)>C(CO32-)>C(OH-)>C(HCO3-)>C(H+).
(4)催化反硝化法可用于治理水中硝酸盐的污染.催化反硝化法中,H2能将NO3-还原为N2,25℃时,反应进行10min,溶液的pH由7变为12.
①N2的电子式为 .
.
②上述反应离子方程式为2NO3-+5H2$\frac{\underline{催化剂}}{△}$ N2+2OH-+4H2O,其平均反应速率v(NO3-)为0.001mol?L-1?min-1
③还原过程中可生成中间产物NO2-,写出3种促进NO2-水解的方法加酸,升高温度,加水.
(1)已知水存在如下平衡:H2O?H++OH-△H>0,现欲使平衡向右移动,且所得溶液显碱性,选择方法是B.
A.向水中加入NaHSO4固体 B.向水中加Na2CO3固体
C.加热至100℃[其中c(H+)=1×10-6 mol•L-1]D.向水中加入NH4Cl固体
(2)常温下,浓度均为0.1mol•L-1的下列五种钠盐溶液的pH如下表;
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
为0.01mol•L-1的下列四种酸的溶液分别稀释100倍,pH变化最大的是C(填编号).
A.HCN B.HClOC.CH3COOHD.H2CO3
(3)实验室中常用NaOH来进行洗气和提纯.当400mL 1mol•L-1的NaOH溶液吸收标准状况
下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为C(Na+)>C(CO32-)>C(OH-)>C(HCO3-)>C(H+).
(4)催化反硝化法可用于治理水中硝酸盐的污染.催化反硝化法中,H2能将NO3-还原为N2,25℃时,反应进行10min,溶液的pH由7变为12.
①N2的电子式为
 .
.②上述反应离子方程式为2NO3-+5H2$\frac{\underline{催化剂}}{△}$ N2+2OH-+4H2O,其平均反应速率v(NO3-)为0.001mol?L-1?min-1
③还原过程中可生成中间产物NO2-,写出3种促进NO2-水解的方法加酸,升高温度,加水.
1.有机物结构如图所示,下列说法中不正确的是( )
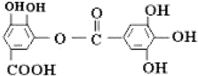

| A. | 常温下,能与NaHCO3溶液反应放出CO2 | |
| B. | 该有机物的分子式为C14H10O9 | |
| C. | 与稀H2SO4共热,生成2种有机物 | |
| D. | 能发生碱性水解反应,1mol该有机物完全反应消耗掉8molNaOH |
12.下列物质加入金属钠,不反应的是( )
| A. | 煤油 | B. | 水 | C. | 酒精 | D. | 氯化钠溶液 |
9.下列说法正确的是( )
| A. | 甘油、氨基酸在一定条件下都能发生酯化反应 | |
| B. | 菲的结构简式为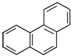 ,它的一硝基取代物共有10种 ,它的一硝基取代物共有10种 | |
| C. | 某有机物分子式为C14H12O2,球棍模型如图所示,此有机物能与NaHCO3溶液反应放出CO2气体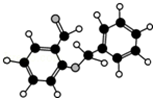 | |
| D. | 分别完全燃烧等物质的量的果糖和蔗糖,消耗的氧气量相等 |