题目内容
1.已知:| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2 800 | 2 050 | 714 | 191 |
(2)制铝时,电解Al2O3而不电解AlCl3的原因是是共价化合物,熔融态时不电离,难导电.
分析 (1)氧化镁熔点比氯化镁熔点高,熔融离子晶体要消耗能源;
(2)氯化铝是共价化合物,熔融状态下不导电.
解答 解:(1)氧化镁熔点比氯化镁熔点高,熔融离子晶体要消耗能源,从而增加成本,为减少成本,所以用熔融氯化镁冶炼镁,
故答案为:MgO的熔点比MgCl2的熔点高,MgO熔融时耗费更多能源,增加成本;
(2)氯化铝是共价化合物,熔融状态下不导电,以分子存在,所以冶炼铝用熔融氧化铝,故答案为:是共价化合物,熔融态时不电离,难导电.
点评 本题考查金属冶炼,明确金属活泼性强弱与冶炼方法关系即可解答,活泼金属采用电解其熔融盐或氧化物的方法冶炼,注意铝不能电解氯化铝冶炼,为易错点.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
17.下列反应的离子方程式正确的是( )
| A. | 苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| B. | FeSO4的酸性溶液中加H2O2:2Fe2++H2O2+2H+═2Fe3++2H2O | |
| C. | 用氨水吸收少量的SO2:NH3•H2O+SO2═NH4++HSO3- | |
| D. | 碳酸氢钠溶液中加入过量石灰水:HCO3-+OH-═CO32-+H2O |
12.下列物质加入金属钠,不反应的是( )
| A. | 煤油 | B. | 水 | C. | 酒精 | D. | 氯化钠溶液 |
9.下列说法正确的是( )
| A. | 甘油、氨基酸在一定条件下都能发生酯化反应 | |
| B. | 菲的结构简式为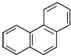 ,它的一硝基取代物共有10种 ,它的一硝基取代物共有10种 | |
| C. | 某有机物分子式为C14H12O2,球棍模型如图所示,此有机物能与NaHCO3溶液反应放出CO2气体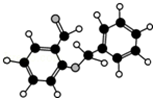 | |
| D. | 分别完全燃烧等物质的量的果糖和蔗糖,消耗的氧气量相等 |
16. 下表为元素周期表中第四周期的部分元素(从左到右按原子序数递增排列),根据要求回答下列各小题:
下表为元素周期表中第四周期的部分元素(从左到右按原子序数递增排列),根据要求回答下列各小题:
(1)在以上元素的基态原子的电子排布中4s轨道上只有1个电子的元素有K、Cr、Cu(填元素符号).
(2)根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域:s区、p区、d区、ds区和f区,以上十二种元素分别属于s区、d区和ds区,则属于s区的元素有2种,属于d区的元素有8种.
(3)试比较:第一电离能I1(Ga)<I1(Ge)(填“>”、“<”或“=”).
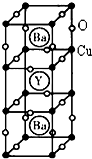
(4)钇钡铜氧是一种新型节能高温超导体,其晶胞结构如图所示,研究发现,此高温超导体中的Cu元素有两种价态,分别为+2价和+3价,Y元素的化合价为+3价,Ba元素的化合价为+2价.
①该物质的化学式为:YCu3Ba2O7.
②该物质中Cu2+与Cu3+的原子个数比为:2:1.
 下表为元素周期表中第四周期的部分元素(从左到右按原子序数递增排列),根据要求回答下列各小题:
下表为元素周期表中第四周期的部分元素(从左到右按原子序数递增排列),根据要求回答下列各小题:| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge |
(2)根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域:s区、p区、d区、ds区和f区,以上十二种元素分别属于s区、d区和ds区,则属于s区的元素有2种,属于d区的元素有8种.
(3)试比较:第一电离能I1(Ga)<I1(Ge)(填“>”、“<”或“=”).
(4)钇钡铜氧是一种新型节能高温超导体,其晶胞结构如图所示,研究发现,此高温超导体中的Cu元素有两种价态,分别为+2价和+3价,Y元素的化合价为+3价,Ba元素的化合价为+2价.
①该物质的化学式为:YCu3Ba2O7.
②该物质中Cu2+与Cu3+的原子个数比为:2:1.
6.下列实验的操作和所用的试剂都正确的是( )
| A. | 要鉴别己烯中是否混有少量甲苯,应先加足量溴水,然后再加入酸性高锰酸钾溶液 | |
| B. | 配制浓硫酸和浓硝酸的混酸时,将浓硝酸沿壁缓缓倒入到浓硫酸中 | |
| C. | 制硝基苯时,将盛有混合液的试管直接在酒精灯火焰上加热 | |
| D. | 除去溴苯中少量的溴,可以加水后分液 |
11.科学合理的综合利用海水资源,是开发和利用自然资源的重要方面.下列不需要化学变化就能够从水中获得的物质是( )
| A. | 氯、溴、碘 | B. | 食盐、淡水 | C. | 烧碱、氢气 | D. | 钠、镁、铝 |
