题目内容
9.下列反应的离子方程式书写正确的是( )| A. | 明矾溶液中加入过量的氨水:Al3++4OH-═AlO2-+2H2O | |
| B. | 铜粉与98.3%的硫酸加热下反应 Cu+4H++SO42-$\frac{\underline{\;\;△\;\;}}{\;}$Cu2++SO2↑+2H2O | |
| C. | 氯化亚铁溶液中加入硝酸:3Fe2++4H++NO3-═3Fe3++2H2O+NO↑ | |
| D. | 澄清石灰水中加入少量的NaHCO3溶液:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- |
分析 A.注意氢氧化铝不溶于弱碱的性质;
B.浓硫酸应写成化学式;
C.亚铁离子与硝酸发生氧化还原反应生成铁离子、NO和水;
D.澄清石灰水中加入少量的NaHCO3溶液,生成碳酸钙和水.
解答 解:A.明矾溶液中加入过量的氨水反应生成氢氧化铝,氢氧化铝与氨水不反应,离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故A错误;
B.铜粉与98.3%的硫酸加热下反应的离子方程式为2H2SO4(浓)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$Cu2++SO2↑+2H2O+SO42-,故B错误;
C.亚铁离子与硝酸发生氧化还原反应生成铁离子、NO和水,反应的离子方程式为3Fe2++4H++NO3-═3Fe3++2H2O+NO↑,故C正确;
D.澄清石灰水中加入少量的NaHCO3溶液,生成碳酸钙和水,反应的离子方程式为Ca2++OH-+HCO3-═CaCO3↓+H2O,故D错误.
故选C.
点评 本题考查了离子方程式的正误判断,为中等难度的试题,注意明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.

练习册系列答案
相关题目
19.下列物质放置在空气中因发生氧化还原反应而变质的是( )
| A. | NaOH | B. | Na2O | C. | FeCl2 | D. | CaO |
20.已知 2SO2(g)+O2(g)?2SO3△H=-197KJ/mol下列说法正确的是( )
| A. | 其他条件不变,改变反应物的量,△H发生改变 | |
| B. | 上述反应生成1mol SO3,放热少于98.5KJ | |
| C. | 相同条件下加入2molSO2(g)、1mol O2(g) 充分反应放热等于197KJ | |
| D. | 相同条件下加入1molSO2(g)、0.5mol O2(g) 充分反应放热为Q1 kJ,若在相同容器中加入1mol SO3充分反应吸热等于Q2kJ,Q1kJ+Q2 kJ=98.5kJ |
17.下列反应的离子方程式正确的是( )
| A. | 苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| B. | FeSO4的酸性溶液中加H2O2:2Fe2++H2O2+2H+═2Fe3++2H2O | |
| C. | 用氨水吸收少量的SO2:NH3•H2O+SO2═NH4++HSO3- | |
| D. | 碳酸氢钠溶液中加入过量石灰水:HCO3-+OH-═CO32-+H2O |
4.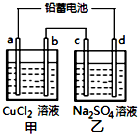 用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为:
用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为:
Pb(s)+PbO2(s)+2H2SO4(aq)$?_{放电}^{充电}$2PbSO4(s)+2H2O(l)
电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )
 用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为:
用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为:Pb(s)+PbO2(s)+2H2SO4(aq)$?_{放电}^{充电}$2PbSO4(s)+2H2O(l)
电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )
| A. | d极为阴极 | |
| B. | 放电时铅蓄电池负极的电极反应式为:PbO2(s)+4H+(aq)+SO42-(aq)+4e-═PbSO4(s)+2H2O(l) | |
| C. | 若利用甲池精炼铜,b极应为粗铜 | |
| D. | 若四个电极材料均为石墨,当析出6.4gCu时,两池中共产生气体3.36L(标准状况下) |
14.运用化学知识解决生产、生活中的有关问题备受关注.请回答下列问题:
(1)已知水存在如下平衡:H2O?H++OH-△H>0,现欲使平衡向右移动,且所得溶液显碱性,选择方法是B.
A.向水中加入NaHSO4固体 B.向水中加Na2CO3固体
C.加热至100℃[其中c(H+)=1×10-6 mol•L-1]D.向水中加入NH4Cl固体
(2)常温下,浓度均为0.1mol•L-1的下列五种钠盐溶液的pH如下表;
上述盐溶液中的阴离子,结合H+能力最强的是CO32-,根据表中数据,浓度均
为0.01mol•L-1的下列四种酸的溶液分别稀释100倍,pH变化最大的是C(填编号).
A.HCN B.HClOC.CH3COOHD.H2CO3
(3)实验室中常用NaOH来进行洗气和提纯.当400mL 1mol•L-1的NaOH溶液吸收标准状况
下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为C(Na+)>C(CO32-)>C(OH-)>C(HCO3-)>C(H+).
(4)催化反硝化法可用于治理水中硝酸盐的污染.催化反硝化法中,H2能将NO3-还原为N2,25℃时,反应进行10min,溶液的pH由7变为12.
①N2的电子式为 .
.
②上述反应离子方程式为2NO3-+5H2$\frac{\underline{催化剂}}{△}$ N2+2OH-+4H2O,其平均反应速率v(NO3-)为0.001mol?L-1?min-1
③还原过程中可生成中间产物NO2-,写出3种促进NO2-水解的方法加酸,升高温度,加水.
(1)已知水存在如下平衡:H2O?H++OH-△H>0,现欲使平衡向右移动,且所得溶液显碱性,选择方法是B.
A.向水中加入NaHSO4固体 B.向水中加Na2CO3固体
C.加热至100℃[其中c(H+)=1×10-6 mol•L-1]D.向水中加入NH4Cl固体
(2)常温下,浓度均为0.1mol•L-1的下列五种钠盐溶液的pH如下表;
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
为0.01mol•L-1的下列四种酸的溶液分别稀释100倍,pH变化最大的是C(填编号).
A.HCN B.HClOC.CH3COOHD.H2CO3
(3)实验室中常用NaOH来进行洗气和提纯.当400mL 1mol•L-1的NaOH溶液吸收标准状况
下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为C(Na+)>C(CO32-)>C(OH-)>C(HCO3-)>C(H+).
(4)催化反硝化法可用于治理水中硝酸盐的污染.催化反硝化法中,H2能将NO3-还原为N2,25℃时,反应进行10min,溶液的pH由7变为12.
①N2的电子式为
 .
.②上述反应离子方程式为2NO3-+5H2$\frac{\underline{催化剂}}{△}$ N2+2OH-+4H2O,其平均反应速率v(NO3-)为0.001mol?L-1?min-1
③还原过程中可生成中间产物NO2-,写出3种促进NO2-水解的方法加酸,升高温度,加水.
1.有机物结构如图所示,下列说法中不正确的是( )
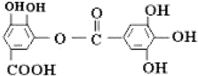

| A. | 常温下,能与NaHCO3溶液反应放出CO2 | |
| B. | 该有机物的分子式为C14H10O9 | |
| C. | 与稀H2SO4共热,生成2种有机物 | |
| D. | 能发生碱性水解反应,1mol该有机物完全反应消耗掉8molNaOH |
12.下列物质加入金属钠,不反应的是( )
| A. | 煤油 | B. | 水 | C. | 酒精 | D. | 氯化钠溶液 |