题目内容
17. 如图所示,A、B、C是实验室常用的三种制取气体的装置,提供的药品有:大理石、浓盐酸、稀盐酸、锌粒、二氧化锰、氯化铵、熟石灰.现欲利用这些药品分别制取NH3、Cl2、H2、CO2四种气体,试回答下列问题:
如图所示,A、B、C是实验室常用的三种制取气体的装置,提供的药品有:大理石、浓盐酸、稀盐酸、锌粒、二氧化锰、氯化铵、熟石灰.现欲利用这些药品分别制取NH3、Cl2、H2、CO2四种气体,试回答下列问题:(1)选用A装置可制取的气体有NH3,选用B装置可制取的气体有H2、CO2,选用C装置可制取的气体有Cl2.
(2)标号①、②的仪器名称分别为分液漏斗、圆底烧瓶.
(3)写出利用上述有关药品制取氨气的化学方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑.若要制得干燥氨气,可选用下列干燥剂中的a (填序号).
a.生石灰 b.浓硫酸 c.五氧化二磷.
分析 (1)A装置制备气体的特点:固体与固体加热;
(2)熟悉仪器的图形说出其名称;
(3)氯化铵与氢氧化钙在加热条件下反应生成氯化钙、氨气和水;生石灰为碱性干燥剂;浓硫酸、五氧化二磷为酸性干燥剂.
解答 解:(1)A装置制备气体的特点:固体与固体加热,所以可制取氨气;
装置B可用固体和液体在不加热条件下反应,可制备H2、CO2;
C装置的反应物状态是固体、液体混合态,反应条件是加热,所以可制取氯气;
故答案为:NH3;H2、CO2;Cl2;
(2)标号①的名称为分液漏斗;②的仪器的名称为圆底烧瓶,故答案为:分液漏斗; 圆底烧瓶;
(3)氯化铵与氢氧化钙在加热条件下反应生成氯化钙、氨气和水,反应的化学方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑;
氨气为碱性气体,应选择碱性干燥剂,可以用生石灰干燥;
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑;a.
点评 本题考查了气体的制备及装置的选择,明确反应原理是解题关键,注意依据反应物状态和反应条件选择发生装置,依据气体的性质选择干燥剂.

练习册系列答案
相关题目
13.下列物质中的n等于4时,其同类别的同分异构体数目最多的是( )
| A. | 烃CnH2n+2 | B. | 醇CnH2n+2O | C. | 醛CnH2nO | D. | 羧酸CnH2nO2 |
14.运用化学知识解决生产、生活中的有关问题备受关注.请回答下列问题:
(1)已知水存在如下平衡:H2O?H++OH-△H>0,现欲使平衡向右移动,且所得溶液显碱性,选择方法是B.
A.向水中加入NaHSO4固体 B.向水中加Na2CO3固体
C.加热至100℃[其中c(H+)=1×10-6 mol•L-1]D.向水中加入NH4Cl固体
(2)常温下,浓度均为0.1mol•L-1的下列五种钠盐溶液的pH如下表;
上述盐溶液中的阴离子,结合H+能力最强的是CO32-,根据表中数据,浓度均
为0.01mol•L-1的下列四种酸的溶液分别稀释100倍,pH变化最大的是C(填编号).
A.HCN B.HClOC.CH3COOHD.H2CO3
(3)实验室中常用NaOH来进行洗气和提纯.当400mL 1mol•L-1的NaOH溶液吸收标准状况
下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为C(Na+)>C(CO32-)>C(OH-)>C(HCO3-)>C(H+).
(4)催化反硝化法可用于治理水中硝酸盐的污染.催化反硝化法中,H2能将NO3-还原为N2,25℃时,反应进行10min,溶液的pH由7变为12.
①N2的电子式为 .
.
②上述反应离子方程式为2NO3-+5H2$\frac{\underline{催化剂}}{△}$ N2+2OH-+4H2O,其平均反应速率v(NO3-)为0.001mol?L-1?min-1
③还原过程中可生成中间产物NO2-,写出3种促进NO2-水解的方法加酸,升高温度,加水.
(1)已知水存在如下平衡:H2O?H++OH-△H>0,现欲使平衡向右移动,且所得溶液显碱性,选择方法是B.
A.向水中加入NaHSO4固体 B.向水中加Na2CO3固体
C.加热至100℃[其中c(H+)=1×10-6 mol•L-1]D.向水中加入NH4Cl固体
(2)常温下,浓度均为0.1mol•L-1的下列五种钠盐溶液的pH如下表;
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
为0.01mol•L-1的下列四种酸的溶液分别稀释100倍,pH变化最大的是C(填编号).
A.HCN B.HClOC.CH3COOHD.H2CO3
(3)实验室中常用NaOH来进行洗气和提纯.当400mL 1mol•L-1的NaOH溶液吸收标准状况
下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为C(Na+)>C(CO32-)>C(OH-)>C(HCO3-)>C(H+).
(4)催化反硝化法可用于治理水中硝酸盐的污染.催化反硝化法中,H2能将NO3-还原为N2,25℃时,反应进行10min,溶液的pH由7变为12.
①N2的电子式为
 .
.②上述反应离子方程式为2NO3-+5H2$\frac{\underline{催化剂}}{△}$ N2+2OH-+4H2O,其平均反应速率v(NO3-)为0.001mol?L-1?min-1
③还原过程中可生成中间产物NO2-,写出3种促进NO2-水解的方法加酸,升高温度,加水.
12.下列物质加入金属钠,不反应的是( )
| A. | 煤油 | B. | 水 | C. | 酒精 | D. | 氯化钠溶液 |
2.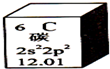 元素周期表是学习化学的重要工具.下图是元素周期表中的一格,以下对该图信息的解读中,不正确的是( )
元素周期表是学习化学的重要工具.下图是元素周期表中的一格,以下对该图信息的解读中,不正确的是( )
 元素周期表是学习化学的重要工具.下图是元素周期表中的一格,以下对该图信息的解读中,不正确的是( )
元素周期表是学习化学的重要工具.下图是元素周期表中的一格,以下对该图信息的解读中,不正确的是( )| A. | 该元素的三种核素质子数均为6 | B. | 该元素原子最外层有4个电子 | ||
| C. | 该元素的相对原子质量为12.01 | D. | 该元素的原子核外有三个电子层 |
9.下列说法正确的是( )
| A. | 甘油、氨基酸在一定条件下都能发生酯化反应 | |
| B. | 菲的结构简式为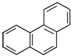 ,它的一硝基取代物共有10种 ,它的一硝基取代物共有10种 | |
| C. | 某有机物分子式为C14H12O2,球棍模型如图所示,此有机物能与NaHCO3溶液反应放出CO2气体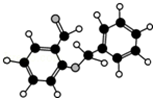 | |
| D. | 分别完全燃烧等物质的量的果糖和蔗糖,消耗的氧气量相等 |
6.下列实验的操作和所用的试剂都正确的是( )
| A. | 要鉴别己烯中是否混有少量甲苯,应先加足量溴水,然后再加入酸性高锰酸钾溶液 | |
| B. | 配制浓硫酸和浓硝酸的混酸时,将浓硝酸沿壁缓缓倒入到浓硫酸中 | |
| C. | 制硝基苯时,将盛有混合液的试管直接在酒精灯火焰上加热 | |
| D. | 除去溴苯中少量的溴,可以加水后分液 |
7.下列表示可燃物燃烧热的热化学方程式书写正确的是( )
| A. | P4(白磷、s)+3O2(g)═2P2O3(s)△H=-1638 kJ/mol | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-802.3 kJ/mol | |
| C. | 2CO(g)+O2(g)═2CO2(g)△H=-566 kJ/mol | |
| D. | H2(g)+1/2O2(g)═H2O(l)△H=-285.8 kJ/mol |

