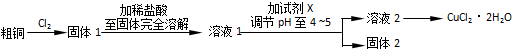题目内容
14.硫化碱法是工业上制备Na2S2O3的方法之一,反应原理为:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2(该反应△H>0),某研究小组在实验室用硫化碱法制备Na2S2O3•5H2O流程如下.
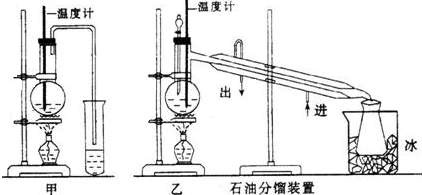
(1)吸硫装置如图所示:

①装置B的作用是检验装置A中SO2的吸收效率,B中试剂是品红或溴水或KMnO4溶液.
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是控制SO2的流速、适当升高温度.(写出两条)
(2)假设本实验所用的Na2CO3含少量NaCl、NaOH,设计实验方案进行检验.(室温时CaCO3饱和溶液的pH=10.2)限选试剂及仪器:稀硝酸、AgNO3溶液、CaCl2溶液、Ca(NO3)2溶液、酚酞溶液、蒸馏水、pH计、烧杯、试管、滴管
| 序号 | 实验操作 | 预期现象 | 结论 |
| ① | 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解,滴加足量稀硝酸,再滴加少量AgNO3溶液,振荡. | 有白色沉淀生成 | 样品含NaCl |
| ② | 另取少量样品于烧杯中,加入适量蒸馏水,充分搅拌溶解,加入过量CaCl2溶液,搅拌,静置,用pH计测定上层清液pH. | 有白色沉淀生成,上层清液pH大于10.2 | 样品含NaOH |
分析 (1)①根据二氧化硫具有还原性、漂白性分析,具有还原性,可用氧化性的物质溴水或KMnO4溶液检验,具有漂白性可用品红检验;
②减缓二氧化硫的流速,适当升高温度,均能使二氧化硫充分反应;
(2)①根据检验氯离子的方法分析;
②NaOH的碱性强,可以通过测定pH来确定是否有NaOH.
解答 解:(1)①二氧化硫具有还原性、漂白性,具有漂白性,能使品红褪色,具有还原性,能被溴水氧化,溴水褪色:SO2+Br2+2H2O=H2SO4+2HBr,二氧化硫与高锰酸钾溶液发生氧化还原反应,硫元素化合价升高,二氧化硫表现还原性,高锰酸钾溶液褪色:5SO2+2KMnO4+2H2O=K2SO4+2MnSO4 +2H2SO4,所以可以用品红、溴水或KMnO4溶液,来检验二氧化硫是否被完全品红吸收,
故答案为:品红或溴水或KMnO4溶液;
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,可以减缓二氧化硫的流速,使二氧化硫与溶液充分接触反应,适当升高温度,也能使二氧化硫充分反应,
故答案为:控制SO2的流速;适当升高温度;
(2)实验所用的Na2CO3含少量NaCl、NaOH,若检验NaCl存在,需先加稀硝酸排除干扰,再加硝酸银溶液,若有白色沉淀生成,说明有NaCl;已知室温时CaCO3饱和溶液的pH=10.2,若要检验氢氧化钠存在,需加入过量CaCl2溶液,把Na2CO3转化为CaCO3,再测量溶液的pH,若pH大于10.2,说明含有NaOH,
故答案为:
| 序号 | 实验操作 | 预期现象 |
| ① | 滴加足量稀硝酸,再滴加少量AgNO3溶液,振荡. | 有白色沉淀生成 |
| ② | 加入过量CaCl2溶液,搅拌,静置,用pH计测定上层清液pH | 有白色沉淀生成,上层清液pH大于10.2 |
点评 本题以硫的化合物的性质为载体,考查氧化还原滴定的应用、实验基本操作等,难度中等,是对知识的综合运用与分析解决问题能力的考查,注意离子的检验.

练习册系列答案
 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案
相关题目
16.下列对化学反应的说法正确的是( )
| A. | 化学反应过程中,分子的种类一定发生改变 | |
| B. | 已知2A(g)+B(g)?C(g)+D(s)△H<0,则该反应一定能自发进行 | |
| C. | 有化学键发生断裂,就有化学反应的发生 | |
| D. | 放热反应的反应速率一定比吸热反应的反应速率大 |
2.对废锌渣(主要成分是ZnO、FeO、Fe2O3、CuO)进行适当处理可制得ZnSO4•7H2O,其流程如图.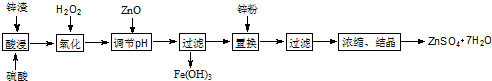
(1)酸浸时温度和时间对锌浸出率的影响如表.
 综合考虑,反应的最佳温度和时间是2h、90℃
综合考虑,反应的最佳温度和时间是2h、90℃
(2)氧化时也可改通空气,其原因是4Fe2++O2+4H+═4Fe3++2H2O.(用离子方程式表示)
(3)加入锌粉的目的是除去Cu2+.
(4)检验Fe3+是否除尽的方法是取第一次过滤后的滤液少许于试管中,加KSCN溶液,若溶液无血红色出现,则Fe3+已除尽.
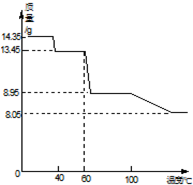
(5)取14.35gZnSO4•7H2O加热分解,加热过程中,固体质量随温度的变化如图所示.写出从60℃到80℃时发生的反应ZnSO4•6H2O$\frac{\underline{\;△\;}}{\;}$ZnSO4•H2O+5H2O.(用化学方程式表示)

(1)酸浸时温度和时间对锌浸出率的影响如表.
| 酸浸时间/h | 酸浸温度/℃ | 锌浸出率/% |
| 2 | 80 | 87 |
| 2 | 90 | 95 |
| 2 | 110 | 85.3 |
| 3 | 95 | 94.5 |
| 2.5 | 95 | 94 |
 综合考虑,反应的最佳温度和时间是2h、90℃
综合考虑,反应的最佳温度和时间是2h、90℃(2)氧化时也可改通空气,其原因是4Fe2++O2+4H+═4Fe3++2H2O.(用离子方程式表示)
(3)加入锌粉的目的是除去Cu2+.
(4)检验Fe3+是否除尽的方法是取第一次过滤后的滤液少许于试管中,加KSCN溶液,若溶液无血红色出现,则Fe3+已除尽.
(5)取14.35gZnSO4•7H2O加热分解,加热过程中,固体质量随温度的变化如图所示.写出从60℃到80℃时发生的反应ZnSO4•6H2O$\frac{\underline{\;△\;}}{\;}$ZnSO4•H2O+5H2O.(用化学方程式表示)
9.某化学小组以苯甲酸为原料,制取苯甲酸甲酯.已知有关物质的沸点如下表:
Ⅰ合成苯甲酸甲酯粗产品
在圆底烧瓶中加入12.2g苯甲酸和20mL甲醇(密度约0.79g•mL-1),再小心加入3mL浓硫酸,混匀后,投入几粒碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品.
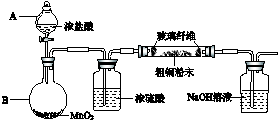
(1)浓硫酸的作用是;催化剂、吸水剂简述混合液体时最后加入浓硫酸的理由:浓硫酸密度较大,且与苯甲酸、甲醇混合放出大量热量,甲醇易挥发.
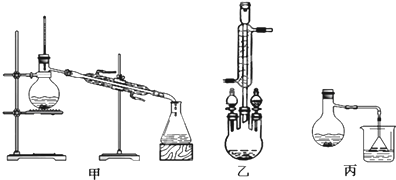
(2)甲、乙、丙三位同学分别设计了如图三套实验室合成苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去).根据有机物的沸点,最好采用装置乙(填“甲”或“乙”或“丙”).
Ⅱ粗产品的精制
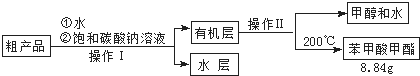
(3)苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用下列流程进行精制,请根据流程图写出操作方法的名称.操作Ⅰ操作Ⅱ.
(4)能否用NaOH溶液代替饱和碳酸钠溶液?否(填“能”或“否”),并简述原因氢氧化钠是强碱,促进苯甲酸甲酯的水解,导致产品损失.
(5)通过计算,苯甲酸甲酯的产率是65%.
| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
在圆底烧瓶中加入12.2g苯甲酸和20mL甲醇(密度约0.79g•mL-1),再小心加入3mL浓硫酸,混匀后,投入几粒碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品.
(1)浓硫酸的作用是;催化剂、吸水剂简述混合液体时最后加入浓硫酸的理由:浓硫酸密度较大,且与苯甲酸、甲醇混合放出大量热量,甲醇易挥发.
(2)甲、乙、丙三位同学分别设计了如图三套实验室合成苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去).根据有机物的沸点,最好采用装置乙(填“甲”或“乙”或“丙”).

Ⅱ粗产品的精制
(3)苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用下列流程进行精制,请根据流程图写出操作方法的名称.操作Ⅰ操作Ⅱ.

(4)能否用NaOH溶液代替饱和碳酸钠溶液?否(填“能”或“否”),并简述原因氢氧化钠是强碱,促进苯甲酸甲酯的水解,导致产品损失.
(5)通过计算,苯甲酸甲酯的产率是65%.
3. 科研生产中常涉及碳的化合物.请回答下列问题:
科研生产中常涉及碳的化合物.请回答下列问题:
(1)700℃时,向容积为3L的密闭容器中充人一定量的CO和H2O,发生反应:CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中测定的部分数据见表(表中t2>t1):
①反应在t1 min内的平均速率为v(H2)=$\frac{0.2}{{t}_{1}}$mol/(L.min);判定t1达平衡状态的理由是t1 min时生成水的物质的量为0.3mol,与t2 min时生成水的物质的量相等,不再随时间发生变化.
②保持其他条件不变,起始时向容器中充入0.9mol CO和1.8mol H2O(g),达平衡时,CO2的物质的量浓度c(CO2)=0.2mol/L.
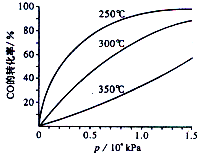
(2)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)?CH3OH(g).CO在不同温度下平衡转化率与压强的关系如图所示.该反应的△H<0(填“>”、“=”或“<”),实际生产条件控制在250℃,1.3×l04kPa左右,选择此压强的理由是在1.3×l04kPa左右,CO的转化率已经较高,再增大压强,对设备要求较高,增大成本.
(3)CH4和H2O(g)通入聚焦太阳能反应器,发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g),将等物质的量的CH4和H2O(g)充入2L恒容密闭反应器,某温度下反应达平衡,平衡常数值K=27,此时测得n(CO)=0.2mol,通过计算求CH4的平衡转化率(保留2位小数).
 科研生产中常涉及碳的化合物.请回答下列问题:
科研生产中常涉及碳的化合物.请回答下列问题:(1)700℃时,向容积为3L的密闭容器中充人一定量的CO和H2O,发生反应:CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中测定的部分数据见表(表中t2>t1):
| 反应时间/min | N[CO(g)]mol | N[H2O(g)]mol |
| 0 | 1.8 | 0.9 |
| t1 | 1.2 | |
| t2 | y | 0.3 |
②保持其他条件不变,起始时向容器中充入0.9mol CO和1.8mol H2O(g),达平衡时,CO2的物质的量浓度c(CO2)=0.2mol/L.
(2)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)?CH3OH(g).CO在不同温度下平衡转化率与压强的关系如图所示.该反应的△H<0(填“>”、“=”或“<”),实际生产条件控制在250℃,1.3×l04kPa左右,选择此压强的理由是在1.3×l04kPa左右,CO的转化率已经较高,再增大压强,对设备要求较高,增大成本.
(3)CH4和H2O(g)通入聚焦太阳能反应器,发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g),将等物质的量的CH4和H2O(g)充入2L恒容密闭反应器,某温度下反应达平衡,平衡常数值K=27,此时测得n(CO)=0.2mol,通过计算求CH4的平衡转化率(保留2位小数).