题目内容
5. 地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题.文献报道某课题组模拟地下水脱氮过程,利用Fe粉和KNO3溶液反应,探究脱氮原理及相关因素对脱氮速率的影响.
地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题.文献报道某课题组模拟地下水脱氮过程,利用Fe粉和KNO3溶液反应,探究脱氮原理及相关因素对脱氮速率的影响.(1)实验前:①先用0.1mol•L-1H2SO4洗涤Fe粉,其目的是去除铁粉表面的氧化物等杂质,然后用蒸馏水洗涤至中性;
②将KNO3溶液的pH调至2.5;
③为防止空气中的O2对脱氮的影响,应向KNO3溶液中通入N2(写化学式).
(2)如图表示足量Fe粉还原上述KNO3溶液过程中,测出的溶液中相关离子浓度、pH随时间的变化关系(部分副反应产物曲线略去).请根据图中信息写出t1时刻前该反应的离子方程式4Fe+NO3-+10H+═4Fe2++NH4++3H2O.t1时刻后,该反应仍在进行,溶液中NH4+的浓度在增大,Fe2+的浓度却没有增大,可能的原因是生成的Fe2+水解.
(3)该课题组对影响脱氮速率的因素提出了如下假设,请你完成假设二和假设三:
假设一:溶液的pH;
假设二:温度;
假设三:铁粉颗粒大小;
…..
(4)请你设计实验验证上述假设一,写出实验步骤及结论.(已知:溶液中的NO3-浓度可用离子色谱仪测定)
实验步骤及结论:①分别取等体积、等浓度的KNO3溶液于不同的试管中;
②调节溶液呈酸性且pH各不相同,并通入N2;
③分别向上述溶液中加入足量等质量的同种铁粉;
④用离子色谱仪测定相同反应时间时各溶液中NO3-的浓度;
若pH不同的KNO3溶液中,测出的NO3-的浓度不同,表明pH对脱氮速率有影响,否则无影响.
分析 (1)铁表面有铁锈加入硫酸可除去,除去溶液中的氧气,可向溶液中通入氮气;
(2)根据图象判断出离子浓度减小的有H+、NO3-,增大的有Fe2+ 和NH4+,故反应物为Fe和H+、NO3-,生成物为Fe2+
和NH4+,可写出化学方程式为4Fe+NO3-+10H+═4Fe2++NH4++3H2O;Fe2+水解呈酸性,当溶液中PH较大时会促进Fe2+水解;
(3)在溶液中进行的反应,影响化学反应速率的外界因素有浓度、温度、溶液酸碱性、催化剂以及固体的表面积大小等;
(4)要验证溶液的pH对反应速率的影响,需其他条件相同,而溶液的酸碱性不同,结合题目中提供的信息,如:通入N2除去O2,用色谱仪测定溶液中NO3-的浓度等.
解答 解:(1)①H2SO4可以除去Fe粉表面的氧化物,
故答案为:去除铁粉表面的氧化物等杂质;
③为防止空气中的O2对脱氮的影响,可向KNO3溶液中通入N2,排出O2,
故答案为:N2;
(2)t1时刻前H+、NO3- 浓度减小,Fe2+ 和NH4+的浓度增大,故反应的离子方程式为4Fe+NO3-+10H+═4Fe2++NH4++3H2O.Fe粉足量,反应仍在进行,Fe2+的浓度没有增大的原因是发生了水解反应,因为溶液的pH增大,促进了水解,
故答案为:4Fe+NO3-+10H+═4Fe2++NH4++3H2O;生成的Fe2+水解;
(3)影响反应速率的因素有浓度、溶液酸碱性、温度、铁粉颗粒大小等,
故答案为:铁粉颗粒大小;
(4)要验证溶液的pH对反应速率的影响,需其他条件相同,而溶液的酸碱性不同,结合题目中提供的信息,如:通入N2除去O2,用色谱仪测定溶液中NO3-的浓度等,
故答案为:
①分别取等体积、等浓度的KNO3溶液于不同的试管中;
②调节溶液呈酸性且pH各不相同,并通入N2;
③分别向上述溶液中加入足量等质量的同种铁粉;
④用离子色谱仪测定相同反应时间时各溶液中NO3-的浓度;
若pH不同的KNO3溶液中,测出的NO3-的浓度不同,表明pH对脱氮速率有影响,否则无影响.
点评 本题考查元素化合物的性质、除杂以及化学反应速率、化学平衡等问题,综合性较强,设计实验步骤,注意语言的条理性和严密性,题目难度中等.

(1)请在图1方框内画出用浓氨水与生石灰制取氨气的装置简图.
(2)制备氨基甲酸铵的装置如图2所示.生成的氨基甲酸铵小晶体悬浮在四氯化碳中.
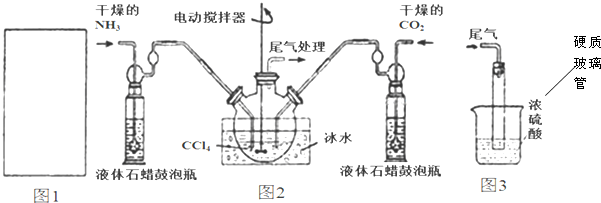
①从反应后的混合物中分离出产品的实验方法是过滤(填操作名称).
②图3中浓硫酸的作用是吸收未反应的氨气,防止空气中的水蒸气进入反应器使氨基甲酸铵水解.
(3)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡.实验测得不同温度下的平衡数据列于下表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A.密闭容器内混合气体的压强不变
B.密闭容器内物质总质量不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
②该分解反应的焓变△H>0(填“>”、“=”或“<”),25.0℃时分解平衡常数的值=1.6384×10-8.
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0℃下达到分解平衡.若在恒温下压缩容器体积,氨基甲酸铵固体的质量将增加(填“增加”,“减少”或“不变”).
| A. |  如图所示,测定中和反应的反应热时,大小两烧杯间填满碎泡沫塑料的作用是固定小烧杯 如图所示,测定中和反应的反应热时,大小两烧杯间填满碎泡沫塑料的作用是固定小烧杯 | |
| B. | 若用50 mL 0.55 mol•L-1的氢氧化钠溶液,分别与50 mL 0.50 mol•L-1的盐酸和50 mLA0.50 mol•L-1的硝酸充分反应,两反应测定的反应热不相等 | |
| C. | 实验时需要记录初始温度T1 和最高温度T2 | |
| D. | 做一次实验根据公式即可得出中和反应的反应热 |
| A. | 第2周期第ⅣA族 | B. | 第3周期第ⅣA族 | C. | 第4周期第ⅡA族 | D. | 第3周期第ⅥA族 |
请回答下列问题:
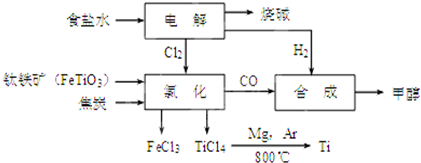
(1)Fe位于元素周期表中第四周期,第ⅤⅢ族.
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式2FeTiO3+6C+7Cl2$\frac{\underline{\;高温\;}}{\;}$2FeCl3+2TiCl4+6CO.
(3)制备TiO2的方法之一是利用TiCl4水解生成TiO2•x H2O,再经焙烧制得.水解时需加入大量的水并加热,请结合化学方程式和必要的文字说明原因:发生TiCl4+(2+x)H2O=TiO2•xH2O+4HCl,加入大量水并加热,HCl挥发,促使水解正向进行
(4)反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于1412℃即可.
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
(6)由CO和H2合成甲醇的方程式是:CO(g)+2H2(g)?CH3OH(g).若不考虑生产过程中物质的任何损失,上述产业链中每合成6mol甲醇,至少需额外补充H25mol.
| A. | 大量燃烧化石燃料排放的废气中含大量CO2、NOx,造成大气污染,从而使雨水的pH=5.6,形成酸雨 | |
| B. | 经过必要的化学变化能从海水中提取粗盐、Mg、Br2等物质 | |
| C. | 针对病毒性流感的扩散情况,要加强环境、个人等的消毒预防,其中消毒剂常选用含氯消毒剂、酒精、双氧水等适宜的物质 | |
| D. | 石油的分馏、石油裂解、煤的气化都包含化学变化 |
| A. | 滴加酚酞试液显红色的溶液中:K+、Na+、NO3-、Cl- | |
| B. | c(H+)=1×10-13 mol•L-1的溶液中:Mg2+、Na+、SO42-、NO3- | |
| C. | pH=1的溶液中:Na+、K+、MnO4-、SO2 | |
| D. | 0.1 mol•L-1FeCl3溶液中:Ba2+、Na+、SCN-、Br- |
| A. | 点燃的酒精灯不小心打翻了,应立即用自来水灭火 | |
| B. | 皮肤沾上少量浓硫酸后,可先用大量水冲洗,再涂上稀碳酸氢钠溶液 | |
| C. | 在蒸馏实验中,加热一段时间后,忘了加入沸石,打开瓶塞立即加入沸石 | |
| D. | 冷凝管用作冷凝回流时,为防止有机物蒸汽逸出,可使用橡胶塞塞住顶端出口 |
