题目内容
12.光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成.(1)工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO,已知CH4、H2和CO的燃烧热(△H)分别为-890.3KJ•mol-1、-285.8KJ•mol-1、-283.0KJ•mol-1,则生成44.8L(标准状况)CO所需热量为247.3 KJ;
(2)COCl2的分解反应为COCl2(g)=Cl2(g)+CO(g)△H=+108KJ•mol-1.反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10min到14min的COCl2浓度变化曲线未示出):
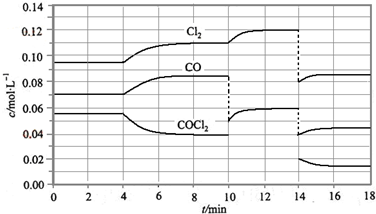
①计算反应在第8min 时的平衡常数K=0.234mol/L;(保留3位小数)
②比较第2min 反应温度T(2)与第8min反应温度T(8)的高低:T(2)<T(8)(填“<”、“>”或“=”);
③若12min 时反应于温度T(8)下重新达到平衡,则此时c(COCl2)=0.031mol•l-1;
④反应进行到14分钟时曲线变化的原因可能是:b
a、加了催化剂 b、增大容器体积 c、降低温度 d、减少CO的物质的量
⑤比较反应物COCl2在5~6min和15~16min时平均反应速率的大小v(5~6)>v(15~16)(填“<”、“>”或“=”),原因是在相同温度时,该反应的反应物浓度越高,反应速率越大.
分析 (1)根据CH4、H2、和CO的燃烧热,可得热化学方程式:
①CH4(g)+2O2(g)=CO2(g)+2H2O(L)△H=-890.3kJ•mol-1
②O2(g)+2H2(g)=2H2O(L)△H=-571.6kJ•mol -1
③2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ•mol-1
根据盖斯定律,①-②-③可得:CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=+247.3 kJ•mol -1,
再根据反应的热化学方程式计算需要的热量;
(2)①由图可知,8min时COCl2的平衡浓度为0.04mol/L,Cl2的平衡浓度为0.11mol/L,CO的平衡浓度为0.085mol/L,代入平衡常数表达式K=$\frac{c(CO)×c(C{l}_{2})}{c(COC{l}_{2})}$计算;
②第8min时反应物的浓度比第2min时减小,生成物浓度增大,平衡向正反应方向移动,4min瞬间浓度不变,不可能为改变压强、浓度,应是改变温度,结合温度对平衡影响判断;
③由图可知,10min瞬间Cl2浓度不变,CO的浓度降低,故改变条件为移走CO,降低CO的浓度,平衡常数不变,与8min到达平衡时的平衡常数相同,由图可知,12min时到达平衡时Cl2的平衡浓度为0.12mol/L,CO的平衡浓度为0.06mol/L,根据平衡常数计算c(COCl2);
④反应进行到14分钟时,改变条件平衡正向移动,瞬间Cl2的浓度、CO的浓度均变为原平衡的$\frac{2}{3}$,可能是增大容器体积;
⑤在5~6 min和15~16 min时反应温度相同,在相同温度时,该反应的反应物浓度越高,反应速率越大,但15~16 min时各组分的浓度都小,因此反应速率小.
解答 解:(1)根据CH4、H2、和CO的燃烧热,可得热化学方程式:
①CH4(g)+2O2(g)=CO2(g)+2H2O(L)△H=-890.3kJ•mol-1
②O2(g)+2H2(g)=2H2O(L)△H=-571.6kJ•mol -1
③2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ•mol-1
根据盖斯定律,①-②-③可得:CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=+247.3 kJ•mol -1,
即生成2molCO,需要吸热247.3 KJ,
故答案为:247.3 KJ;
(2)①由图可知,8min时COCl2的平衡浓度为0.04mol/L,Cl2的平衡浓度为0.11mol/L,CO的平衡浓度为0.085mol/L,K=$\frac{c(CO)×c(C{l}_{2})}{c(COC{l}_{2})}$=$\frac{0.085×0.11}{0.04}$=0.234mol/L,故答案为:0.234mol/L;
②由第2min反应温度变为第8min反应温度时,生成物浓度增大、反应物浓度减小,平衡向正反应方向移动,正反应是吸热反应,升高温度,平衡向正反应方向移动,所以T(2)<T(8),
故答案为:<;
③由图可知,10min瞬间Cl2浓度增大,CO的浓度降低,故改变条件为移走CO,降低CO的浓度,平衡常数不变,与8min到达平衡时的平衡常数相同,由图可知,12min时到达平衡时Cl2的平衡浓度为0.12mol/L,CO的平衡浓度为0.06mol/L,故:$\frac{0.06×0.12}{c(COC{l}_{2})}$=0.234mol/L,解得c(COCl2)=0.031mol/L;
故答案为:0.031;
④反应进行到14分钟时,改变条件平衡正向移动,瞬间Cl2的浓度、CO的浓度均变为原平衡的$\frac{2}{3}$,可能是增大容器体积,故选:b;
⑤在5~6 min和15~16 min时反应温度相同,在相同温度时,该反应的反应物浓度越高,反应速率越大,但15~16 min时各组分的浓度都小,因此反应速率小,即v(5~6)>v(15~16),
故答案为:>;在相同温度时,该反应的反应物浓度越高,反应速率越大.
点评 本题考查比较综合,涉及盖斯定律计算反应热、化学平衡计算、化学平衡移动、平衡常数、浓度随时间变化曲线等,(2)中理解图象中曲线变化趋势及曲线变化可能改变的条件是解本题关键,是对学生综合能力的考查,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | 一定是丙烯 | B. | 可能是丙烷 | C. | 可能是丙烯 | D. | 可能是丙炔 |
| A. | 一定温度和压强下,将 0.5mo1N2和 1.5mo1H2 置于密闭容器中充分反应生成 NH3(g),放 热 19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ•mol-1 | |||||||||
| B. | H2 标准燃烧热△H=-285.8 kJ•mol-1,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)═2H2O(g)△H=-571.6 kJ•mol-1 | |||||||||
| C. | C(石墨)═C(金刚石)△H=+1.9kJ•mol-1,说明石墨比金刚石稳定 | |||||||||
| D. | 通常人们把拆开 1 mol 某化学键所吸收的能量看成该化学键的键能:
|
| A. | 暴露在空气中称量碳酸钠晶体(Na2CO3•10H2O)的时间太长 | |
| B. | 向容量瓶转移液体时,容量瓶事先用蒸馏水洗涤 | |
| C. | 定容时俯视刻度线 | |
| D. | 称量碳酸钠晶体(Na2CO3•10H2O)的烧杯未干燥 |
 在某一容积为5L的密闭容器内,加入 0.3mol的CO和0.3mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:
在某一容积为5L的密闭容器内,加入 0.3mol的CO和0.3mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应: 利用I2O5可消除CO污染或定量测定CO,反应为:
利用I2O5可消除CO污染或定量测定CO,反应为: