题目内容
13.已知1g碳粉在氧气中完全燃烧放出的热量是32.8kJ,试写出表示碳燃烧热的热化学方程式C(s)+O2(g)=CO2(g)△H=-393.6kJ/mol.分析 根据热化学方程式的书写方法可知,应注意化学计量数与反应热的对应关系及各物质的聚集状态来解答.
解答 解:1g碳粉在氧气中完全燃烧放出的热量是32.8kJ,12g碳粉在氧气中完全燃烧并放出393.6kJ热量,则热化学方程式为:C(s)+O2(g)=CO2( g)△H=-393.6 kJ/mol;
故答案为:C(s)+O2(g)=CO2( g)△H=-393.6 kJ/mol.
点评 本题考查热化学方程式的书写,难度中等,注意热化学方程式的意义以及焓变的计算是关键.

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
1.下列叙述正确的是( )
| A. | 一定温度和压强下,将 0.5mo1N2和 1.5mo1H2 置于密闭容器中充分反应生成 NH3(g),放 热 19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ•mol-1 | |||||||||
| B. | H2 标准燃烧热△H=-285.8 kJ•mol-1,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)═2H2O(g)△H=-571.6 kJ•mol-1 | |||||||||
| C. | C(石墨)═C(金刚石)△H=+1.9kJ•mol-1,说明石墨比金刚石稳定 | |||||||||
| D. | 通常人们把拆开 1 mol 某化学键所吸收的能量看成该化学键的键能:
|
5.某Na2CO3样品中含有K2CO3、NaNO3和Ba(NO3)2三种杂质中的一种或两种.现将11g样品加入足量水中,样品全部溶解.再加入过量的CaCl2溶液,得到10g沉淀.对样品所含杂质的正确判断是( )
| A. | 肯定有NaNO3 | B. | 肯定有NaNO3,可能还含有K2CO3 | ||
| C. | 肯定没有Ba(NO3)2,可能有NaNO3 | D. | 肯定没有K2CO3和Ba(NO3)2 |
2.实验室用碳酸钠晶体配制1.00mol•L-1的Na2CO3溶液100mL,造成所配溶液浓度偏低的原因是( )
| A. | 暴露在空气中称量碳酸钠晶体(Na2CO3•10H2O)的时间太长 | |
| B. | 向容量瓶转移液体时,容量瓶事先用蒸馏水洗涤 | |
| C. | 定容时俯视刻度线 | |
| D. | 称量碳酸钠晶体(Na2CO3•10H2O)的烧杯未干燥 |
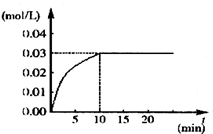 在某一容积为5L的密闭容器内,加入 0.3mol的CO和0.3mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:
在某一容积为5L的密闭容器内,加入 0.3mol的CO和0.3mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:

 .
. .
.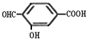 、
、 .
.