题目内容
15.2.0LAlCl3溶液中含Cl-9.03×1023个,则溶液物质的量浓度是( )| A. | 0.1mol/L | B. | 0.25mol/L | C. | 1mol/L | D. | 1.5mol/L |
分析 根据n=$\frac{N}{{N}_{A}}$计算Cl-的物质的量,然后根据氯离子守恒计算n(AlCl3),最后根据c=$\frac{n}{V}$计算AlCl3的物质的量浓度.
解答 解:Cl-的物质的量为:n(Cl-)=$\frac{9.03×1{0}^{23}}{6.02×1{0}^{23}}$=1.5mol,
则氯化铝的物质的量为:n(AlCl3)=$\frac{1}{3}$n(Cl-)=$\frac{1.5mol}{3}$=0.5mol,
故AlCl3的物质的量浓度为:c(AlCl3)=$\frac{0.5mol}{2L}$=0.25mol/L,
故选B.
点评 本题考查了物质的量浓度的计算,题目难度中等,明确物质的量与阿伏伽德罗常数、物质的量浓度之间的关系为解答关键,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
5.下列有关实验的叙述,正确的是(填序号) ( )
| A. | 用NaOH溶液除去乙酸乙酯中混有的乙酸、乙醇,然后分液 | |
| B. | 分馏石油时,温度计的末端必须插入液面下 | |
| C. | 用分液漏斗分离环己烷和水的混合液体 | |
| D. | 用浓氨水洗涤做过银镜反应的试管 | |
| E. | 配制银氨溶液时,将稀氨水慢慢滴加到稀硝酸银溶液中,产生白色沉淀后继续滴加到沉淀刚好溶解为止 |
6.下列生活常见现象中,没有涉及化学变化的是( )
| A. |  光合作用 | B. |  炭烧取暖 | C. |  风力发电 | D. |  电解冶炼 |
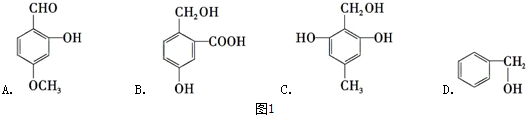
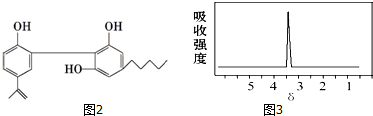
3.有机物分子式为C3H6,下列叙述正确的是( )
| A. | 一定是丙烯 | B. | 可能是丙烷 | C. | 可能是丙烯 | D. | 可能是丙炔 |
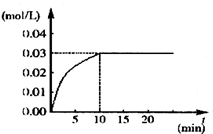 在某一容积为5L的密闭容器内,加入 0.3mol的CO和0.3mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:
在某一容积为5L的密闭容器内,加入 0.3mol的CO和0.3mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应: