题目内容
15.在一固定容积为2L的密闭容器中加入4mol的N2和12mol的H2,在一定条件下发生反应:N2(g)+3H2(g)?2NH3(g)△H<0
(1)若在5min时反应达到平衡,此时测得NH3的物质的量为4mol.则前5min的平均反应速率v(N2)=0.2mol/(L•min).平衡时H2的转化率为50%.该温度下的平衡常数K1=$\frac{4}{27}$(用分数表示);若反应开始时,将1molN2和3molH2通入到该容器,再达新平衡时的平衡常数为K2,则K2=K1(填“>”、“<”或“=”)
(2)平衡后,若要提高H2的转化率,可以采取的措施有C.
A.加了催化剂B.充入一定量的Ne
C.降低反应体系的温度D.再充入2mol的Ne和6mol的H2
(3)其化学平衡常数K与温度T的关系如表所示:
| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
①试比较K1、K2的大小,K1>K2(填“>”、“<”或“=”).
②400℃时,反应2NH3(g)?N2(g)+3H2(g)的化学平衡常数为2,2L的容器中,当测得NH3、N2和H2物质的量分别为6mol、4mol和2mol时,则该反应的v(N2)减>v(N2)增(填“>”、“<”或“=”).
(4)根据化学反应速率和化学平衡理论,联合合成氨的生产实际,你认为下列说法不正确的是C
A.化学反应速率理论可指导怎样在一定时间内快出产品
B.勒夏特列原理可指导怎样使用有限原料多出产品
C.催化剂的使用是提高产品产率的有效方法
D.正确利用化学反应速率和化学反应限度理论都可以提高化工生产的综合经济效益.
分析 (1)依据化学平衡三段式列式计算,若在5min时反应达到平衡,此时测得NH3的物质的量为4mol,
N2(g)+3H2(g)?2NH3(g)
起始量(mol) 4 12 0
变化量(mol) 2 6 4
平衡量(mol) 2 6 4
反应速率v=$\frac{△c}{△t}$,
转化率=$\frac{消耗量}{起始量}$×100%,
平衡常数=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;
若反应开始时,将1molN2和3molH2通入到该容器,再达新平衡时的平衡常数为K2,平衡常数随温度变化,温度不变平衡常数不变;
(2)一定条件下的密闭容器中,该反应达到平衡,要提高H2的转化率,即让化学平衡正向进行即可,一般不考虑加压,可以增加反应物N2的浓度、分离出NH3(减小生成物的浓度),高温条件会使平衡向左进行,加入催化剂不会改变反应物的转化率,增加H2的浓度会使得氢气的转化率减小;
(3)①对于放热反应,温度越高,平衡逆向移动,反应平衡常数越小;
②化学平衡常数,正反应平衡常数和你反应的平衡常数互为倒数,根据浓度熵和平衡常数的关系来确定平衡的移动方向;
(4)化学反应速率是表示物质反应快慢的物理量,在一定条件下反应达到化学平衡状态时,正逆反应速率相等,各物质的浓度不变,化学平衡为动态平衡,当外界条件发生改变时,平衡发生移动,可通过改变外界条件是平衡发生移动,提高化工生产的综合经济效益.
解答 解:(1)依据化学平衡三段式列式计算,若在5min时反应达到平衡,此时测得NH3的物质的量为4mol,
N2(g)+3H2(g)?2NH3(g)
起始量(mol) 4 12 0
变化量(mol) 2 6 4
平衡量(mol) 2 6 4
则前5min的平均反应速率v(N2)=$\frac{△c}{△t}$=$\frac{\frac{2mol}{2L}}{5min}$=0.2mol/(L•min),
平衡时H2的转化率=$\frac{消耗量}{起始量}$×100%=$\frac{6mol}{12mol}$×100%=50%,
平衡状态物质浓度c(N2)=1mol/L,c(H2)=3mol/L,c(NH3)=2mol/L,
平衡常数=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$=$\frac{{2}^{2}}{1×{3}^{3}}$=$\frac{4}{27}$,
若反应开始时,将1molN2和3molH2通入到该容器,再达新平衡时的平衡常数为K2,平衡常数随温度变化,温度不变平衡常数不变,K2=K1,
故答案为:0.2mol/(L•min);50%;$\frac{4}{27}$;=;
(2)一定条件下的密闭容器中,该反应达到平衡,要提高H2的转化率,即让化学平衡正向进行即可,
A.加了催化剂改变反应速率,不改变化学平衡,不能增大氢气转化率,故A错误;
B.充入一定量的Ne是惰性气体,总压增大,气体分压不变,平衡不变,不能增大氢气的转化率,故B错误;
C.反应是放热反应,降低反应体系的温度,平衡正向进行,氢气转化率增大,故C正确;
D.再充入2mol的Ne总压增大,分压不变,平衡不变,加入6mol的H2 增大氮气转化率,氢气转化率减小,故D错误;
故答案为:C;
(3)①该反应正反应是放热反应,升高温度,平衡向逆反应方向移动,生成物浓度减小,反应物浓度增大,所以K1>K2,故答案为:>;
②400℃时,反应2NH3(g)?N2(g)+3H2(g)的化学平衡常数K的值和反应N2(g)+3H2(g)?2NH3(g)的平衡常数呈倒数,所以K=$\frac{1}{0.5}$=2;
容器的体积为0.5L,NH3和N2.H2的物质的量浓度分别为:6mol/L、4mol/L、2mol/L,400℃时,浓度商Qc=$\frac{4×{2}^{3}}{{6}^{2}}$=$\frac{8}{9}$<K=2,说明反应正向进行,因此有v(N2)正>v(N2)逆;
故答案为:2;>;
(4)A.根据影响化学反应速率的因素,可指导怎样在一定时间内快出产品,故A正确;
B.结合影响化学平衡的因素,采用合适的外界条件,是平衡向正反应方向移动,可提高产率,故B正确;
C.化学反应速率是表示物质反应的快慢,不能改变原料的转化率,故C错误;
D.在一定的反应速率的前提下,尽可能使平衡向正反应方向移动,可提高化工生产的综合经济效益,故D正确.
故选C.
点评 本题考查化学平衡常数及影响因素、意义,反应速率计算等,题目难度中等,注意化学平衡常数大小说明反应进行程度,与反应难易无关、与反应速率无关.

| A. |  光合作用 | B. |  炭烧取暖 | C. |  风力发电 | D. |  电解冶炼 |
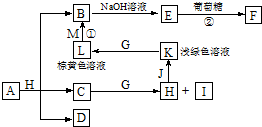
| A. | 肯定有NaNO3 | B. | 肯定有NaNO3,可能还含有K2CO3 | ||
| C. | 肯定没有Ba(NO3)2,可能有NaNO3 | D. | 肯定没有K2CO3和Ba(NO3)2 |
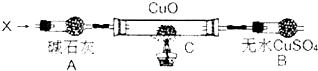
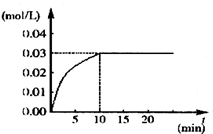 在某一容积为5L的密闭容器内,加入 0.3mol的CO和0.3mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:
在某一容积为5L的密闭容器内,加入 0.3mol的CO和0.3mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应: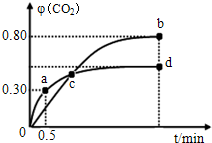 利用I2O5可消除CO污染或定量测定CO,反应为:
利用I2O5可消除CO污染或定量测定CO,反应为: