题目内容
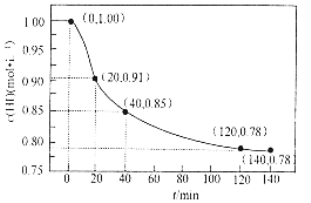
【题目】(1)![]() 碳与适量水蒸气反应生成CO和H2,需吸收
碳与适量水蒸气反应生成CO和H2,需吸收![]() 热量,此反应的热化学方程式为_________________
热量,此反应的热化学方程式为_________________
(2)已知![]() ;
;![]()
![]() ;
;![]()
![]() ;
;![]()
常温下,取体积比4:1的甲烷和氢气的混合气体![]() (标准状况下),经完全燃烧后恢复至室温,则放出的热量为___________
(标准状况下),经完全燃烧后恢复至室温,则放出的热量为___________
【答案】C(s) + H2O(g) = CO(g) + H2(g) ΔH= + 131.28 kJ·mol-1 0.4Q1 + 0.05 molQ3
【解析】
⑴1 g碳与适量水蒸气反应生成CO和H2,需吸收10.94KJ热量,则1 mol碳即12 g与适量水蒸气反应生成CO和H2,需吸收131.28 4KJ热量,此反应的热化学方程式为
C(s) + H2O(g) = CO(g) + H2(g) ΔH= + 131.28 kJ·mol-1
⑵常温下,取体积比4:1的甲烷和氢气的混合气体11.2 L即物质的量为0.5 mol,甲烷物质的量为0.4 mol,氢气的物质的量为0.1 mol,根据方程式①③,经完全燃烧后恢复至室温,则放出的热量为0.4Q1 + 0.05 molQ3。
故答案为0.4Q1 + 0.05 molQ3。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目