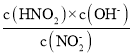题目内容
【题目】有下列分子或离子:①CS2, ②PCl3, ③H2S, ④CH2O, ⑤H3O+, ⑥NH![]() ,⑦BF3,⑧SO2。
,⑦BF3,⑧SO2。
(1)粒子的立体构型为直线形的有____________ (填序号,下同);
(2)粒子的立体构型为V形的有______________;
(3)粒子的立体构型为平面三角形的有______________;
(4)粒子的立体构型为三角锥形的有______________;
(5)粒子的立体构型为正四面体形的有______________。
【答案】① ③⑧ ④⑦ ② ⑤ ⑥
【解析】
根据杂化轨道数=σ键数目+孤对电子对数,确定杂化轨道数,再结合孤对电子对数确定空间构型,然后依次分析解答。
①CS2分子中每个S原子和C原子形成两个共用电子对,所以C原子价层电子对个数是2,孤对电子对数为0,空间构型为直线形;
②PCl3分子中σ键数目为3,孤对电子对数为1,空间构型为三角锥型;
③H2S分子中σ键数目为2,孤对电子对数为2,空间构型为V型;
④CH2O分子中心原子C的σ键数目为3,孤对电子对数为0,空间构型为平面三角形,但不是正三角形结构;
⑤H3O+分子中心原子O的σ键数目为3,孤对电子对数为1,空间构型为三角锥形;
⑥NH4+分子中心原子N的σ键数目为4,孤对电子对数为0,空间构型为正四面体形;
⑦BF3分子中心原子B的σ键数目为3,孤对电子对数为0,空间构型为平面正三角型;
⑧SO2分子中价层电子对个数=2+![]() ×(6-2×2)=3,含有1个孤电子对,空间构型为V形;
×(6-2×2)=3,含有1个孤电子对,空间构型为V形;
(1)其中为直线型的有①,故答案为:①;
(2)其中为V型的有③⑧,故答案为:③⑧;
(3)其中为平面三角型的有④⑦,故答案为:④⑦;
(4)其中为三角锥型的有②⑤,故答案为:②⑤;
(5)其中为正四面体型的有⑥,故答案为:⑥。

 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
按下列合成步骤回答问题:

苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/°C | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
(1)在a中加入15mL无水苯和少量铁屑。在b中小心加入4.0mL液态溴。向a中滴入几滴溴,有白雾产生,是因为生成了___________气体,发生的反应方程式______________________________。采用分液漏斗滴加溴的方式,这样的好处是_______________;c的作用_________________; 冷凝水的方向是________________(填写“上进下出”或者“下进上出”);
(2)液溴滴完后,经过下列步骤分离提纯:
(a)向a中加入10mL水,然后通过过滤除去未反应的铁屑;
(b)滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤。NaOH溶液洗涤的作用是_________;
(c)向分出的粗溴苯中加入少量的无水硫酸镁,静置、过滤。加入硫酸镁的目的是_____;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为________,要进一步提纯,下列操作中必须的是________(填入正确选项前的字母);
a.重结晶 b.过滤 c.蒸馏 d.萃取
(4)在该实验中,a的容积最适合的是___(填入正确选项前的字母)。
a.25mL b.50mL c.250mL d.500mL