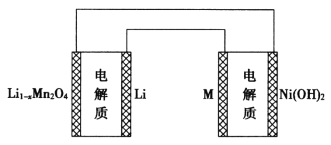
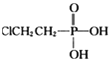题目内容
【题目】如果阿伏加德罗常数的值为NA。下列说法正确的是( )
A.![]() 与
与![]() 所含的分子数一定相等
所含的分子数一定相等
B.将![]() 钠用铝箱包裹并刺小孔,与足量水充分反应生成H2分子数为
钠用铝箱包裹并刺小孔,与足量水充分反应生成H2分子数为![]()
C.![]() 与足量水反应转移
与足量水反应转移![]() 电子
电子
D.高温下,![]() 与足量水蒸气完全反应,转移的电子数为
与足量水蒸气完全反应,转移的电子数为![]()
【答案】C
【解析】
A. 氧气所处的状态不明确,故已知体积的氧气物质的量无法计算,故A错误;
B. 4.6g钠的物质的量为0.2mol,和水反应生成0.1mol氢气,而钠和水反应后生成的NaOH能继续和铝反应生成氢气,故最终生成的氢气的物质的量大于0.1mo1,即分子数多于0.1NA个,故B错误;
C. 过氧化钠和水的反应为歧化反应,氧元素由-1价歧化为0价和-2价,故0.1mol过氧化钠转移0.1NA个电子,故C正确;
D. 16.8g铁的物质的量为n=![]() =0.3mol,而铁和水蒸气反应后变为+
=0.3mol,而铁和水蒸气反应后变为+![]() 价,故0.3mol铁转移电子为0.8NA个,故D错误;
价,故0.3mol铁转移电子为0.8NA个,故D错误;
故选C。

 口算题天天练系列答案
口算题天天练系列答案【题目】[化学一选修3:物质结构与性质
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Ti3+的未成对电子数有__________个。
②LiBH4由Li+和BH4-构成,BH4-的空间构型是__________,B原子的杂化轨道类型是_____。
③某储氢材料是第三周期金属元素M的氢化物,M的部分电离能如下表所示:
I1/kJ·mol-1 | I2/kJ·mol-1 | I3/kJ·mol-1 | I4/kJ·mol-1 | I5/kJ·mol-1 |
738 | 1451 | 7733 | 10540 | 13630 |
M是_______(填元素符号),判断理由为_______________。
(2)铜晶体中铜原子的堆积方式如图所示,铜晶体中原子的堆积模型属于____________。

(3)A原子的价电子排布式为3s23p5,铜与A 形成化合物的晶胞如图所示(黑点代表铜原子)。
①该晶体的化学式为______________。
②该化合物难溶于水但易溶于氨水,其原因是_____________ ,此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为____________。
③己知该晶体的密度为ρg·cm-3,阿伏伽德罗常数为NA,己知该晶体中Cu原子和A原子之间的最短距离为体对角线的1/4,则该晶体中Cu原子和A原子之间的最短距离为________pm。
【题目】已知化学反应①:Fe(s)+CO2(g)![]() FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)![]() FeO(s)+H2(g),其平衡常数为K2。在温度973 K和
FeO(s)+H2(g),其平衡常数为K2。在温度973 K和
1173 K情况下,K1、K2的值分别如下:
温度 | K1 | K2 |
973 K | 1.47 | 2.38 |
1173 K | 2.15 | 1.67 |
(1)通过表格中的数值可以推断:反应①是________(填“吸热”或“放热”)反应。
(2)现有反应③:CO2(g)+H2(g)![]() CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3=_________。
CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3=_________。
(3)能判断反应③已达平衡状态的是_________。
A.容器中压强不变
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=c(CO)
(4)根据反应①与②可推导出K1、K2与K3之间的关系式_________。据此关系式及上表数据,也能推断出反应③是____________(填“吸热”或“放热”)反应。要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施是_______(填写序号)。
A.缩小反应容器容积 B.扩大反应容器容积
C.降低温度 D.升高温度
E.使用合适的催化剂 F.设法减少CO的量