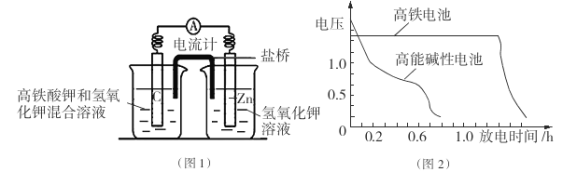
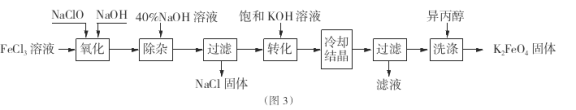
题目内容
【题目】铬(VI)的化合物是有毒物,已知Cr(III)盐的毒性只有Cr(VI)盐的0.5%,所以将废水中Cr(VI)转化为Cr(III)是处理Cr(VI)废水的方向。某铬盐厂生产过程中排出含Cr2O72-的工业酸性废水.为防止污染环境,现采用下列两种方法进行处理后再排出。
方法一:化学法
用FeSO4·7H2O处理含铬废水的优点是经过加配料比后可用最终的产物制备铁氧体复合氧化物 (用Crx3+Fe2-xFe2+O4表示)的原料。
(1)在利用化学法处理时,FeSO4把废水中Cr2O72-还原的离子方程式为______。
(2)在pH<4的含铬(VI)废水中,加入FeSO4·7H2O的质量应为废水中CrO3质量的 倍,才能使得到的固体产物符合铁氧体复合氧化物的组成。而在实际操作中一般要___ (填“大于”、“小于”)这个比例,原因为_____________。
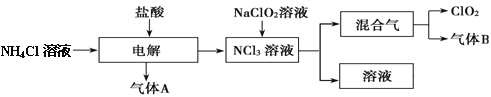
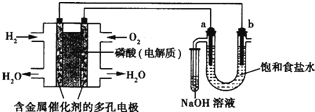
方法二: 电解法的工艺流程如下
![]()
在整个处理过程中,Cr2O72-被还原为Cr3+,溶液的pH值逐渐升高,最后滤出的沉淀有Cr(OH)3和Fe(OH)3,试分析这个污水处理过程,回答:
(3)加入适量食盐的作用为________,选择Fe做电极的原因是____________。
(4)随着电解和溶液中反应的进行,阴极区溶液pH____(填“变大”、“变小”),鼓入空气的原因是_______________。
(5)电解过程中当H+浓度小到一定程度时,便会析出Cr(OH)3、Fe(OH)3沉淀,已知常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至l0-5mol/L,溶液的pH应至少为___________。
【答案】
![]()
(2)13.9倍;大于 因绿矾易被氧化,故试剂用量可能要比理论值大。
(3)加入食盐,是增加污水中离子浓度,增强导电能力。阳极:![]() 阴极:
阴极:![]() 以生成的亚铁离子为还原剂,在酸性溶液中与Cr2O72-离子发生氧化还原反应使Cr2O72-离子被还原成Cr3+。
以生成的亚铁离子为还原剂,在酸性溶液中与Cr2O72-离子发生氧化还原反应使Cr2O72-离子被还原成Cr3+。
(4)变大 在处理过程中鼓入空气,让空气中氧气充分与氢氧化亚铁反应,成为容易分离的氢氧化铬和氢氧化铁,使废水含铬量降到可排放标准。
(5)5
【解析】
试题分析:(1)在利用化学法处理时,FeSO4把废水中Cr2O72-还原的离子方程式为![]()
(2)根据Crx3+Fe2-xFe2+O4结合第一小题反应方程式可得出x=0.5mol,即三价铬离子为0.5mol,三价铁为1.5mol,该氧化物中还有1mol亚铁离子存在,所以的出绿矾与CrO3的物质的量之比为5:1,质量比为278*5/100=13.9倍,才能使得到的固体产物符合铁氧体复合氧化物的组成。而在实际操作中一般要大于这个比例,原因为因绿矾易被氧化,故试剂用量可能要比理论值大。
(3)加入适量食盐的作用为增加污水中离子浓度,增强导电能力,选择Fe做电极的原因是阳极:![]() 阴极:
阴极:![]() 以生成的亚铁离子为还原剂,在酸性溶液中与Cr2O72-离子发生氧化还原反应使Cr2O72-离子被还原成Cr3+。
以生成的亚铁离子为还原剂,在酸性溶液中与Cr2O72-离子发生氧化还原反应使Cr2O72-离子被还原成Cr3+。
(4)随着电解和溶液中反应的进行,阴极区氢离子放电,产生氢氧根离子,所以溶液pH变大,鼓入空气的原因是在处理过程中鼓入空气,让空气中氧气充分与氢氧化亚铁反应,成为容易分离的氢氧化铬和氢氧化铁,使废水含铬量降到可排放标准。
(5)根据Cr(OH)3的溶度积常数,Ksp=10-32=C(Cr3+)*C(OH-)3带入数据计算出C(OH-)=10-9即pH=5