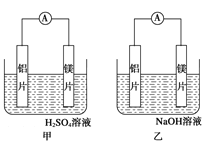
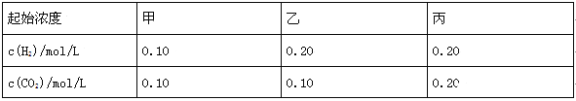
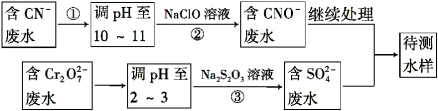
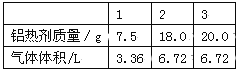
题目内容
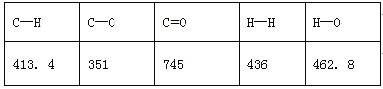
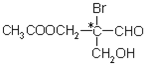
【题目】有机物分子中,当某个碳原子连接着四个不同的原子或原子团时,这种碳原子称为“手性碳原子”。例如,如图有机物分子中带“*”碳原子就是手性碳原子。该有机物分别发生下列反应,生成的有机物分子中仍含有手性碳原子的( )
A. 与乙酸发生酯化反应
B. 与NaOH水溶液反应
C. 与银氨溶液作用只发生银镜反应
D. 催化剂作用下与H2反应
【答案】C
【解析】试题分析:A.该有机物与乙酸反应生成的酯中,原来的手性碳原子现在连接两个CH3COOCH2-,所以没有手性碳原子,故A不选;B.该有机物与氢氧化钠溶液反应后生成的醇中,原来的手性碳原子现在连接两个-CH2OH,所以没有手性碳原子,故B不选;C.该有机物与银氨溶液反应后的生成的有机物中,原来的手性碳原子现在连接的原子或原子团是:一个溴原子、一个-CH2OH、一个CH3COOCH2-、一个-COOH,所以该原子仍然是手性碳原子,故C选;D.该有机物在催化剂作用下与氢气反应,原来的手性碳原子现在连接两个-CH2OH,所以没有手性碳原子,故D不选;故选C。

练习册系列答案
相关题目
【题目】在密闭容器中加入2.0 mol SO2和1.0 mol O2,一定条件下发生如下反应2SO2+ O2![]() 2SO3。反应达到平衡后,各物质的物质的量可能为
2SO3。反应达到平衡后,各物质的物质的量可能为
n(SO2)/mol | n(O2)/mol | n(SO3)/mol | |
A | 1.0 | 0 | 1.0 |
B | 0 | 0 | 2.0 |
C | 0.2 | 0.1 | 1.8 |
D | 1.5 | 0.75 | 1.0 |