题目内容
【题目】氨和硝酸都是重要的化学品。
(1)画出采用氨催化氧化法合成硝酸的反应原理流程图:(要求注明试剂、反应条件)
(示例:![]() )
)
(2)向饱和氯化钠和浓氨水的混合溶液中通入过量CO2从而析出NaHCO3晶体,是侯氏制碱法的关键步骤,用一个化学方程式表示该反应原理 。在0.1 mol/L的稀氨水中,下列式子成立的是 。
A.c(NH3·H2O) + c(NH3) + c(NH4+) = 0.1 mol/L
B.c(NH3·H2O) > c(NH3) + c(NH4+)
C.c(H+) > c(OH-)
D.c(NH4+) + c(H+) = c(OH-)
(3)A是中学化学常见气体,打开装有A的集气瓶,瓶口出现白雾,将A与氨气混合,立即出现大量白烟,生成物质B,则A的分子式为 ,物质B中所含的化学键类型有 。
(4)将6.4 g铜粉投入一定量的浓硝酸中,铜完全溶解,产生标准状况下的混合气体3.36 L,其中两种成分气体的体积比为 ,反应中总共消耗的硝酸 mol。
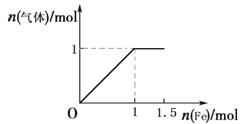
(5)向含4 mol HNO3的稀溶液中,逐渐加入铁粉至过量。假设生成的气体只有一种,请在坐标系中画出n(气体)随n(Fe)变化的示意图,并标出n(气体)的最大值。
(6)氨气和硝酸生产的氮肥硝酸铵受热或受撞击容易分解,若分解时只生成两种氧化物,写出该反应的化学方程式 。
【答案】
(1)![]() ;
;
(2)NaCl+ NH3+H2O+CO2 = NaHCO3↓+NH4Cl;ABD;
(3)HCl,(极性)共价键、离子键(和配位键);
(4)1:5或5:1,0.35
(5)
(6)NH4NO3 ![]() N2O↑ + 2H2O;
N2O↑ + 2H2O;
【解析】
试题分析:(1)在工业上用N2与氢气化合形成氨气,氨气催化氧化产生NO,NO被氧气氧化产生NO2,NO2被水吸收得到硝酸,则用氨催化氧化法合成硝酸的反应原理流程图是:![]() ;(2)向饱和氯化钠和浓氨水的混合溶液中通入过量CO2从而析出NaHCO3晶体,反应的化学方程式是NaCl+ NH3+H2O+CO2 = NaHCO3↓+NH4Cl。A.在0.1 mol/L的稀氨水中, N元素的存在形式有NH3·H2O、NH3、NH4+,根据N元素守恒可知 c(NH3·H2O) + c(NH3) + c(NH4+) = 0.1 mol/L,正确;B.氨气溶于水,绝大多数发生反应产生NH3·H2O,只有少量发生电离产生NH4+,所以微粒的浓度关系是:c(NH3·H2O) > c(NH3) + c(NH4+),正确;C.在氨水中存在水的电离平衡及NH3·H2O 的电离平衡,二者都电离产生OH-,只有水电离产生H+,所以离子浓度关系是c(H+) <c(OH-),错误;D.在氨水中存在水的电离平衡及NH3·H2O 的电离平衡,二者都电离产生OH-,只有水电离产生H+,根据二者电离产生的离子浓度关系可知c(NH4+) + c(H+) = c(OH-),正确;(3)A是中学化学常见气体,打开装有A的集气瓶,瓶口出现白雾,将A与氨气混合,立即出现大量白烟,生成物质B,则A的分子式为HCl,NH3与HCl反应产生的物质B是NH4Cl,其中所含的化学键类型有(极性)共价键、离子键(和配位键);(4)6.4 g铜的物质的量是n(Cu)=6.4g÷64g/mol=0.1mol,将6.4 g铜粉投入一定量的浓硝酸中,会发生反应:Cu+4HNO3(浓)=Cu(NO3)2+NO2↑+2H2O;3Cu+8HNO3(稀)=2Cu(NO3)2+2NO↑+4H2O,Cu是+2价的金属,0.1molCu失去电子的物质的量是0.2mol,反应产生的NO、NO2混合气体在标准状况下体积是3.36 L,物质的量是n=3.36L÷22.4L/mol=0.15mol,假设NO、NO2的物质的量分别是x、y,则3x+y=0.2mol;x+y=0.15mol,解得x=0.025mol,y=0.125mol,根据n=V/Vm可知二者的体积比等于它们的物质的量的比,所以V(NO):V(NO2)= 0.025mol:0.125mol=1:5;V(NO2): V(NO) =5:1;根据N元素守恒可知n(HNO3)=2n[Cu(NO3)2]+n(气体)=2×0.1mol+0.15mol=0.35mol; (5)根据铁和硝酸反应的实质,开始铁全部被硝酸氧化为硝酸铁,反应的方程式是:Fe+4H++NO3-=Fe3++NO↑+2H2O,根据方程式可知4molHNO3发生反应产生1molNO气体,反应消耗1molFe,后发生反应2Fe3++Fe=3Fe2+,无气体产生,所以用图像表示为
;(2)向饱和氯化钠和浓氨水的混合溶液中通入过量CO2从而析出NaHCO3晶体,反应的化学方程式是NaCl+ NH3+H2O+CO2 = NaHCO3↓+NH4Cl。A.在0.1 mol/L的稀氨水中, N元素的存在形式有NH3·H2O、NH3、NH4+,根据N元素守恒可知 c(NH3·H2O) + c(NH3) + c(NH4+) = 0.1 mol/L,正确;B.氨气溶于水,绝大多数发生反应产生NH3·H2O,只有少量发生电离产生NH4+,所以微粒的浓度关系是:c(NH3·H2O) > c(NH3) + c(NH4+),正确;C.在氨水中存在水的电离平衡及NH3·H2O 的电离平衡,二者都电离产生OH-,只有水电离产生H+,所以离子浓度关系是c(H+) <c(OH-),错误;D.在氨水中存在水的电离平衡及NH3·H2O 的电离平衡,二者都电离产生OH-,只有水电离产生H+,根据二者电离产生的离子浓度关系可知c(NH4+) + c(H+) = c(OH-),正确;(3)A是中学化学常见气体,打开装有A的集气瓶,瓶口出现白雾,将A与氨气混合,立即出现大量白烟,生成物质B,则A的分子式为HCl,NH3与HCl反应产生的物质B是NH4Cl,其中所含的化学键类型有(极性)共价键、离子键(和配位键);(4)6.4 g铜的物质的量是n(Cu)=6.4g÷64g/mol=0.1mol,将6.4 g铜粉投入一定量的浓硝酸中,会发生反应:Cu+4HNO3(浓)=Cu(NO3)2+NO2↑+2H2O;3Cu+8HNO3(稀)=2Cu(NO3)2+2NO↑+4H2O,Cu是+2价的金属,0.1molCu失去电子的物质的量是0.2mol,反应产生的NO、NO2混合气体在标准状况下体积是3.36 L,物质的量是n=3.36L÷22.4L/mol=0.15mol,假设NO、NO2的物质的量分别是x、y,则3x+y=0.2mol;x+y=0.15mol,解得x=0.025mol,y=0.125mol,根据n=V/Vm可知二者的体积比等于它们的物质的量的比,所以V(NO):V(NO2)= 0.025mol:0.125mol=1:5;V(NO2): V(NO) =5:1;根据N元素守恒可知n(HNO3)=2n[Cu(NO3)2]+n(气体)=2×0.1mol+0.15mol=0.35mol; (5)根据铁和硝酸反应的实质,开始铁全部被硝酸氧化为硝酸铁,反应的方程式是:Fe+4H++NO3-=Fe3++NO↑+2H2O,根据方程式可知4molHNO3发生反应产生1molNO气体,反应消耗1molFe,后发生反应2Fe3++Fe=3Fe2+,无气体产生,所以用图像表示为 ;(6)氨气和硝酸生产的氮肥硝酸铵受热或受撞击容易分解,若分解时只生成两种氧化物只能是N2O、H2O,根据电子守恒、原子守恒,可得该反应的化学方程式是NH4NO3
;(6)氨气和硝酸生产的氮肥硝酸铵受热或受撞击容易分解,若分解时只生成两种氧化物只能是N2O、H2O,根据电子守恒、原子守恒,可得该反应的化学方程式是NH4NO3 ![]() N2O↑ + 2H2O。
N2O↑ + 2H2O。