题目内容
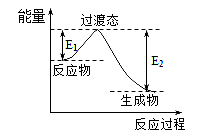
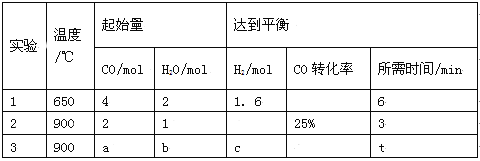
【题目】2011年9月29日我国成功发射的“天宫一号”飞行器的外壳覆盖了一种新型结构陶瓷材料,其主要成分是氮化硅,该陶瓷材料可由石英固体与焦炭颗粒在高温的氮气流中通过如下反应制得:SiO2+C+N2![]() Si3N4+CO。该反应变化过程中的能量变化如图所示。回答以下问题。
Si3N4+CO。该反应变化过程中的能量变化如图所示。回答以下问题。

(1)上述反应中的还原剂是__________,其还原产物是________。
(2)该反应________(填“吸热”或“放热”),反应热ΔH________0(填“>”、“<”或“=”)。
【答案】(1)C ;Si3N4 (2)放热 ;<
【解析】
试题分析:(1)根据方程式SiO2+C+N2![]() Si3N4+CO可知反应中C元素的化合价从0价升高到+2价,失去电子,C是还原剂。N元素的化合价从0价降低到-3价,氮气是氧化剂,则Si3N4是还原产物;
Si3N4+CO可知反应中C元素的化合价从0价升高到+2价,失去电子,C是还原剂。N元素的化合价从0价降低到-3价,氮气是氧化剂,则Si3N4是还原产物;
(2)根据图像可知反应物的总能量高于生成物总能量,则反应是放热反应,ΔH<0。

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目
【题目】下表是元素周期表的一部分,所列字母分别代表一种元素:
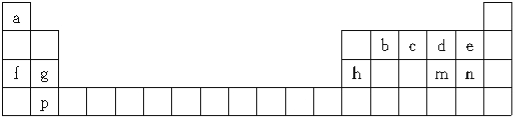
(1)m元素在周期表中的位置是 。
(2)下列有关说法正确的是 (填字母)。
A.b、c、d元素的非金属性逐渐增大 |
B.f、g、h元素的原子半径逐渐减小 |
C.md2与bd2的化学性质类似,都具有氧化性 |
D.e、n的最高价含氧酸的酸性强弱:e>n |
E.a、f分别与d组成的化合物中所含化学键类型完全相同
F.该表中只有4种元素组成的单质具有导电性
(3)a、c、n按原子个数比为4:1:1构成的化合物是 。