题目内容
【题目】为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物含量显得尤为重要。
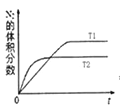
(1)汽车内燃机工作时会引起N2和O2的反应:N2+O2═2NO,是导致汽车尾气中含有NO的原因之一;在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如图所示,根据图象判断反应N2(g)+O2(g)═2NO(g)的△H__________ 0(填“>”或“<”)。
(2)NOx是汽车尾气中的主要污染物之一。汽车发动机工作时会引起N2和O2反应,其能量变化如图所示,写出该反应的热化学方程式_____________________;
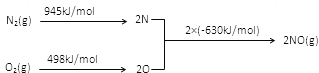
【答案】(1)>; (2) N2(g)+O2(g)=2NO(g) ΔH=+183 kJ·mol-1
【解析】
试题分析:(1)从图上可以看出T2温度时先达到平衡,所以T2>T1,T1时N2的体积分数高于T2,说明温度升高化学平衡正向移动,正反应为吸热反应,答案为:>;(2)根据能量变化图可以看出1mol氮气分解为2molN原子吸热945kJ,1molO2分解为2O原子吸热498kJ,2molN原子和2molO原子形成2molNO放热2×630kJ,所以氮气和氧气生成2molNO吸热183kJ,反应的热化学方程式为:N2(g)+O2(g)=2NO(g) ΔH=+183 kJ·mol-1,答案为:N2(g)+O2(g)=2NO(g) ΔH=+183 kJ·mol-1.

练习册系列答案
相关题目