题目内容
【题目】高铁酸盐在能源、环保等方面有着广泛的用途。
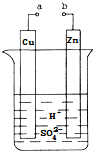
I.高铁酸钾( K2Fe04)不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。如图1是高铁电池的模拟实验装置:
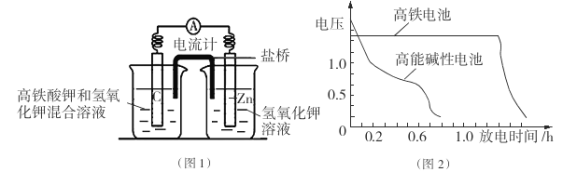
(1)该电池放电时正极的电极反应式为 ;若维持电流强度为1A,电池工作10 min ,理论消耗Zn g(已知F=96500 C/mol)。
(2)盐桥中盛有饱和KC1溶液,此盐桥中氯离子向 移动(填“左”或“右”);若用阳离子交换膜代替盐桥,则钾离子向 移动(填“左”或“右”)。
(3)图2为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有 。
Ⅱ.工业上湿法制备K2Fe04的工艺流程如图3。
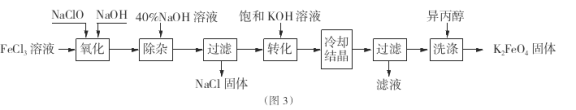
(4)完成“氧化”过程中反应的化学方程式:
![]()
其中氧化剂是 (填化学式)。
(5)加入饱和KOH溶液的目的是
(6)已知25℃时Ksp[Fe(OH)3]=4.0×![]() ,此温度下若在实验室中配制5mol/L
,此温度下若在实验室中配制5mol/L
l00mL FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入 mL 2 mol/L的盐酸(忽略加入盐酸体积)。
【答案】(1)FeO42﹣+4H2O+3e﹣=Fe(OH)3↓+5OH﹣;0.2
(2)右;左
(3)使用时间长、工作电压稳定
(4)2FeCl3+10NaOH+3NaClO═2Na2FeO4+9NaCl+5H2O;NaClO
(5)增大K+浓度,促进高铁酸钾晶体析出。
(6)2.5
【解析】
试题分析:Ⅰ.(1)根据电池装置,Zn做负极,C为正极,高铁酸钾的氧化性很强,正极上高铁酸钾发生还原反应生成Fe(OH)3,正极电极反应式为:FeO42-+4H2O+3e-═Fe(OH)3↓+5OH-,若维持电流强度为1A,电池工作十分钟,通过电子为![]() ,则理论消耗Zn为
,则理论消耗Zn为![]() ×
×![]() ×65g/mol=0.2g。
×65g/mol=0.2g。
故答案为:FeO42-+4H2O+3e-═Fe(OH)3↓+5OH--;0.2;
(2)盐桥中阴离子移向负极移动,盐桥起的作用是使两个半电池连成一个通路,使两溶液保持电中性,起到平衡电荷,构成闭合回路,放电时盐桥中氯离子向右移动,用某种高分子材料制成阳离子交换膜代替盐桥,则钾离子向左移动。
故答案为:右;左;
(3)由图可知高铁电池的优点有:使用时间长、工作电压稳定。
故答案为:使用时间长、工作电压稳定;
Ⅱ.氯化铁溶液中加入次氯酸钠和氢氧化钠,发生反应为:2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O,将Na2FeO4粗产品在40%KOH溶液中溶解,过滤除去杂质NaCl,加入饱和KOH溶液后,将Na2FeO4转化为溶解度更小的K2FeO4,反应方程式为Na2FeO4+2KOH=K2FeO4+2NaOH,冷却结晶、过滤,高铁酸钾易溶于水,难溶于异丙醇,用异丙醇代替水洗涤产品可以减少高铁酸钾的损耗,同时洗去高铁酸钾晶体表面的KOH和其他杂质,得到纯产品高铁酸钾。
(4)其中Fe元素化合价由+3价升高为+6价,共升高3价,Cl元素化合价由+1价降低为-1,价,共降低2价,化合价升降最小公倍数为6,则FeCl3的系数为2、NaClO的系数为3,再根据原子守恒配平后反应方程式为:2FeCl3+10NaOH+3NaClO═2Na2FeO4+9NaCl+5H2O,NaClO所含元素化合价降低是氧化剂。
故答案为:2、10、3、2、9、5;NaClO;
(5)加入饱和KOH溶液可以增大K+的浓度,减小高铁酸钾的溶解,促进高铁酸钾晶体析出。
故答案为:增大K+浓度,促进高铁酸钾晶体析出;
(6)溶液中c(Fe3+)=5mol/L,根据Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-)=4.0×10-38,可知开始沉淀时c(OH-)=2×10-13mol/L,则溶液中c(H+)= ![]() mol/L=0.05mol/L,根据稀释定律,需要盐酸的体积为
mol/L=0.05mol/L,根据稀释定律,需要盐酸的体积为![]() =2.5mL。
=2.5mL。
故答案为:2.5。

【题目】在密闭容器中加入2.0 mol SO2和1.0 mol O2,一定条件下发生如下反应2SO2+ O2![]() 2SO3。反应达到平衡后,各物质的物质的量可能为
2SO3。反应达到平衡后,各物质的物质的量可能为
n(SO2)/mol | n(O2)/mol | n(SO3)/mol | |
A | 1.0 | 0 | 1.0 |
B | 0 | 0 | 2.0 |
C | 0.2 | 0.1 | 1.8 |
D | 1.5 | 0.75 | 1.0 |