题目内容
【题目】用酸性氢氧燃料电池电解饱和食盐水的装置如图所示(a、b为石墨电极,不考虑U形管中气体的溶解且a上产生的气体全部进入小试管中)。
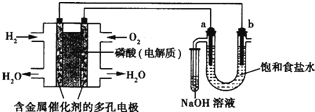
(1)写出通入H2这一极的电极反应_________,通入O2这一极的电极反应为_________。
(2)a为_________极,电极反应为_________ 。
(3)b为_________极,电极反应为_________。
(4)在25℃,当燃料电池中消耗 0.02g H2时,U形管中液体的体积为200mL(忽略实验过程中体积的变化), 求此时U形管中溶液的pH。
【答案】 (1)H2 - 2e- = 2H+;O2 + 4e- + 4H+ = 2H2O;
(2)阳 ;2Cl- - 2e- = Cl2;
(3) 阴;2H+ + 2e- = H2;
(4) 13 ;
【解析】
试题分析:左边能自发的进行氧化还原反应,为原电池,氢气失电子发生氧化反应,则通入氢气的电极是负极,通入氧气的电极是正极,正极上氧气得电子发生还原反应;右边是电解池,与电源正极相连的是电解池的阳极,与电源负极相连的是电解池的阴极,所以a是阳极,b是阴极,阳极上氯离子放电,阴极上氢离子放电,电子从负极流向阴极,从阳极流向正极。
(1)通入H2的一极为负极,发生氧化反应,电极反应为H2 - 2e- = 2H+,通入O2的一极为正极,发生还原反应,电极反应为O2 + 4e- + 4H+ = 2H2O,故答案为:H2 - 2e- = 2H+;O2 + 4e- + 4H+ = 2H2O;
(2)a为阳极,电极反应为2Cl- - 2e- = Cl2,故答案为:阳 ;2Cl- - 2e- = Cl2;
(3)b为阴极,电极反应为2H+ + 2e- = H2,故答案为:阴;2H+ + 2e- = H2;
(4)0.02g H2的物质的量为![]() =0.01mol,U形管中阴极反应的氢离子的物质的量=0.01mol×2=0.02mol,c(OH-)=
=0.01mol,U形管中阴极反应的氢离子的物质的量=0.01mol×2=0.02mol,c(OH-)=![]() =0.1mol/L,溶液的pH=13,故答案为:13。
=0.1mol/L,溶液的pH=13,故答案为:13。

 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案