题目内容
【题目】硫及其化合物有许多用途,相关物质的物理常数如表所示:
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
熔点/℃ | -85.5 | 115.2 | >600(分解) | -75.5 | 16.8 | 10.3 |
沸点/℃ | -60.3 | 444.6 | -10.0 | 45.0 | 337.0 |
回答下列问题:
(1)Fe在元素周期表的位置为__,基态S原子电子占据最高能级的电子云轮廓图为__形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是__。
(3)图a为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为___。
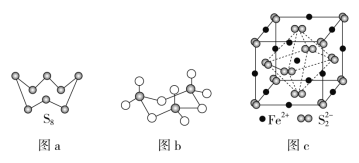
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为__形,其中共价键的类型有__种;固体三氧化硫中存在如图b所示的三聚分子,该分子中S原子的杂化轨道类型为__。
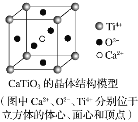
(5)FeS2晶体的晶胞如图c所示。晶胞边长为apm、FeS2的密度为ρg·cm-3,阿伏加德罗常数的值为NA,则FeS2的摩尔质量M的计算表达式为__g·mol-1;晶胞中Fe2+位于S22-所形成的正八面体的体心,该正八面体的边长为___pm。
【答案】第四周期第Ⅷ族 哑铃(纺锤) H2S S8相对分子质量大,分子间范德华力强 平面三角 2 sp3 ![]() ×10-30
×10-30 ![]() a
a
【解析】
(1)根据基态原子的核外电子排布式及原子轨道类型分析解答;
(2)根据价层电子对互斥理论,计算中心原子的价层电子对数;
(3)根据晶体类型及影响分子间作用力因素分析解答;
(4)根据价层电子对互斥理论分析分子空间结构及轨道杂化类型;
(5)均摊法计算该晶胞中S22-和Fe2+个数,晶胞中Fe2+位于S22-所形成的八面体的体心,该正八面体的边长为每个面对角线长度的一半。
(1) Fe为26号元素,基态原子电子排布式为1s22s22p63s2 3p63d64s2,所以位于第四周期第VIII族;S为16号原子,基态S原子电子占据的能级有1s、2s、2p、3s、3p,最高能级为3p,其电子云轮廓图为哑铃形,故答案为:第四周期第Ⅷ族;哑铃;
(2) H2S中S原子原子价层电子对个数=![]() ,SO2中S原子原子价层电子对个数=
,SO2中S原子原子价层电子对个数=![]() ,SO3中S原子价层电子对个数=
,SO3中S原子价层电子对个数=![]() ,则中心原子价层电子对数不同于其他分子的是H2S,故答案为:H2S;
,则中心原子价层电子对数不同于其他分子的是H2S,故答案为:H2S;
(3) S8、SO2都分子晶体,分子晶体熔沸点与其分子间作用力成正比,分子间作用力与其相对分子质量成正比,S8相对分子质量大于SO2,所以分子间作用力S8大于SO2,导致熔沸点S8大于SO2,故答案为:S8相对分子质量大,分子间范德华力强;
(4) SO3的气态分子中S原子价层电子对个数为![]() ,且不含孤电子对,根据价层电子对互斥理论判断其空间构型为平面正三角形;该分子中S-O原子之间存在σ和离域大π键,所以共价键类型2种;该分子中每个S原子价层电子对个数都是4,根据价层电子对互斥理论判断S原子杂化类型为sp3,故答案为:平面三角;2;sp3;
,且不含孤电子对,根据价层电子对互斥理论判断其空间构型为平面正三角形;该分子中S-O原子之间存在σ和离域大π键,所以共价键类型2种;该分子中每个S原子价层电子对个数都是4,根据价层电子对互斥理论判断S原子杂化类型为sp3,故答案为:平面三角;2;sp3;
(5)如图C,S22-在顶点和面心,数目为:![]() ,Fe2+在体心和棱上,数目为:
,Fe2+在体心和棱上,数目为:![]() ,所以每个晶胞含有4个FeS2,在根据其晶体密度
,所以每个晶胞含有4个FeS2,在根据其晶体密度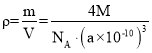 ,则M的计算表达式为:
,则M的计算表达式为:![]() ×10-30;晶胞中Fe2+位于S22-所形成的八面体的体心,该正八面体的边长为每个面对角线长度的一半,即为
×10-30;晶胞中Fe2+位于S22-所形成的八面体的体心,该正八面体的边长为每个面对角线长度的一半,即为![]() a,故答案为:
a,故答案为:![]() ×10-30;
×10-30;![]() a。
a。

 名校课堂系列答案
名校课堂系列答案【题目】光纤通讯是光导纤维传送信号的一种通讯手段,合成光导纤维及氮化硅(一种无机涂层)的工艺流程如下:

回答下列问题:
(1)反应I的化学方程式为2C+SiO2![]() Si+2CO↑,其中还原剂为_______________,产物Si在周期表中位于_______________,该反应涉及的副反应可能有C+SiO2
Si+2CO↑,其中还原剂为_______________,产物Si在周期表中位于_______________,该反应涉及的副反应可能有C+SiO2![]() Si+CO2↑(碳不足)和__________________________________(碳足量)。
Si+CO2↑(碳不足)和__________________________________(碳足量)。
(2)经反应Ⅱ所得的四氯化硅粗品中所含的物质如下:
组分名称 | SiCl4 | SiHCl3 | SiH2Cl2 | HCl | BCl3 | PCl3 |
质量分数 | 0.545 | 0.405 | 0.0462 | 0.0003 | 0.00193 | 0.00157 |
沸点/℃ | 57.6 | 31.8 | 8.2 | -85 | 12.5 | 75.5 |
图中“操作X”的名称为______________________;PCl3的电子式为________________。
(3)反应IV的化学方程式为SiCl4+4NH3![]() Si3N4+12HCl,若向一2L恒容密闭容器中投入1molSiCl4和1molNH3,6min后反应完全,则0~6min内,HCl的平均反应速率为__________mol/(L·min)。反应III的与IV产生的气体相同,则反应III化学方程式为__________________。反应III中的原料气H2和O2在碱性条件下可构成燃料电池,其正极反应的电极方程式为__________________。
Si3N4+12HCl,若向一2L恒容密闭容器中投入1molSiCl4和1molNH3,6min后反应完全,则0~6min内,HCl的平均反应速率为__________mol/(L·min)。反应III的与IV产生的气体相同,则反应III化学方程式为__________________。反应III中的原料气H2和O2在碱性条件下可构成燃料电池,其正极反应的电极方程式为__________________。
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据:
苯 | 溴 | 溴苯 | |
密度/g·cm﹣3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
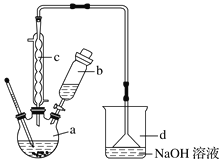
按下列合成步骤回答问题:
(1)在a中加入15mL无水苯和少量铁屑,在b中小心加入4.0mL液态溴,向a中滴入几滴溴,有白色烟雾产生,是因为生成了_______气体,继续滴加液溴滴完。铁屑的作用是___________;a中发生的化学反应方程式______________________。
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤。NaOH溶液洗涤的作用是____;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是_______;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为______,要进一步提纯,下列操作中必须的是______(填入正确选项前的字母);
A.重结晶B.过滤C.蒸馏D.萃取
(4)在该实验中,a的容积最适合的是_______(填入正确选项前的字母)。
A.25mL B.50mL C.250mL D.500mL
【题目】氮及其化合物是科学家们一直在探究的问题,它们在工农业生产和生命活动中起着重要的作用。回答下列问题。
I.NOx和SO2在空气中存在下列平衡:
2NO(g)+O2(g)2NO2(g)△H=﹣113.0kJmol﹣1
2SO2(g)+O2(g)2SO3(g)△H=﹣196.6kJmol﹣1
SO2通常在二氧化氮的存在下,进一步被氧化,生成SO3.
(1)写出NO2和SO2反应的热化学方程式为_________.
(2)随温度升高,该反应化学平衡常数变化趋势是_____.
II.(1)目前,应用NH3的催化还原法来进行烟气氮氧化物脱除,化学反应可表示为:2NH3(g)+NO(g)+NO2(g)== 2N2(g)+3H2O(g) △H<0,该反应中,反应物总能量_____(填“>”、“<”或“=”)生成物总能量。
(2)已知4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g) ΔH=-1800 kJ·mol-1,将2 mol NH3、3 mol NO的混合气体分别置于a、b、c三个10 L恒容密闭容器中,使反应在不同条件下进行,反应过程中c(N2)随时间的变化如图所示。
5N2(g)+6H2O(g) ΔH=-1800 kJ·mol-1,将2 mol NH3、3 mol NO的混合气体分别置于a、b、c三个10 L恒容密闭容器中,使反应在不同条件下进行,反应过程中c(N2)随时间的变化如图所示。
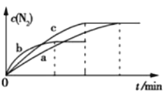
①与容器a中的反应相比,容器b中的反应改变的实验条件可能是_______,判断的依据是___________________。
②一定温度下,下列能说明反应已达到平衡状态的是____
A.H2O(g)与NO的生成速率相等 B.混合气体的密度保持不变
C.ΔH保持不变 D.容器的总压强保持不变
(3)用NH3和Cl2反应可以制备具有强氧化性的三氯胺(三氯胺在中性、酸性环境中会发生强烈水解,生成具有强杀菌作用的物质),方程式为3Cl2(g)+NH3(g)![]() NCl3(l)+3HCl(g),向容积均为1L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2molCl2和2molNH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
NCl3(l)+3HCl(g),向容积均为1L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2molCl2和2molNH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
t /min | 0 | 40 | 80 | 120 | 160 |
n(Cl2)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(Cl2)(乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①T℃__________400℃(填“>”或“<”)。
②该反应的ΔH__________0(填“>”或“<”)。
③该反应自发进行的条件是__________(填高温、低温、任何温度)。
④对该反应,下列说法正确的是_________(填选项字母)。
A.若容器内气体密度不变,则表明反应达到平衡状态
B.若容器内Cl2和NH3物质的量之比为3∶1,则表明反应达到平衡状态
C.反应达到平衡后,其他条件不变,在原容器中按![]() 继续充入一定量反应物,达新平衡后Cl2的转化率增大
继续充入一定量反应物,达新平衡后Cl2的转化率增大
D.反应达到平衡后,其他条件不变,加入一定量的NC13,平衡将向逆反应方向移动