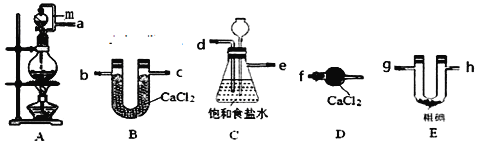
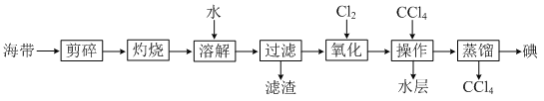
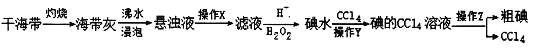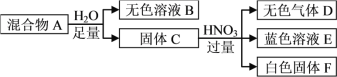题目内容
【题目】已知:①H+(aq)+OH-(aq)===H2O(l) ΔH1=-57.3 kJ·mol-1,
②H2(g)+![]() O2(g)===H2O(g) ΔH2=-241.8 kJ·mol-1,下列有关说法正确的是( )
O2(g)===H2O(g) ΔH2=-241.8 kJ·mol-1,下列有关说法正确的是( )
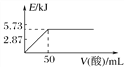
A. 向含0.1molNaOH的溶液中加入一定体积的0.1mol·L-1乙二酸,反应中的能量变化如图所示
B. H2SO4(aq)+Ba(OH)2(aq)===BaSO4(s)+2H2O(l) ΔH=-114.6 kJ·mol-1
C. 氢气的标准燃烧热为241.8 kJ·mol-1
D. 若反应②中水为液态,则同样条件下的反应热:ΔH>ΔH2
【答案】A
【解析】乙二酸是弱酸,向含0.1molNaOH的溶液中加入一定体积的0.1mol·L-1乙二酸放出热量小于57.3 kJ,故A正确;H2SO4(aq)+Ba(OH)2(aq)===BaSO4(s)+2H2O(l) 由于有硫酸钡沉淀生成,放出的热量大于114.6 kJ,故B错误;氢气的标准燃烧热是生成液态水放出的热量,故C错误;若反应②中水为液态,则同样条件下的反应热:ΔH<ΔH2,故D错误。

练习册系列答案
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
相关题目
【题目】在KI溶液中存在下列平衡:I2(aq)+I-(aq)=I3-(aq)。测得不同温度下该反应的平衡常数K如表所示:
t/℃ | 5 | 15 | 25 | 35 | 50 |
K | 1 100 | 841 | 689 | 533 | 409 |
下列说法正确的是 ( )。
A.反应I2(aq)+I-(aq)![]() I3-(aq)的ΔH>0
I3-(aq)的ΔH>0
B.其他条件不变,升高温度,溶液中c(I3-)减小
C.该反应的平衡常数表达式为K=![]()
D.25 ℃时,向溶液中加入少量KI固体,平衡常数K小于689