题目内容
【题目】光纤通讯是光导纤维传送信号的一种通讯手段,合成光导纤维及氮化硅(一种无机涂层)的工艺流程如下:
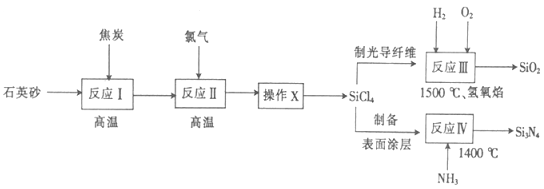
回答下列问题:
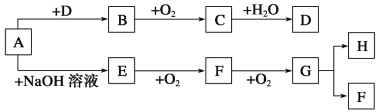
(1)反应I的化学方程式为2C+SiO2![]() Si+2CO↑,其中还原剂为_______________,产物Si在周期表中位于_______________,该反应涉及的副反应可能有C+SiO2
Si+2CO↑,其中还原剂为_______________,产物Si在周期表中位于_______________,该反应涉及的副反应可能有C+SiO2![]() Si+CO2↑(碳不足)和__________________________________(碳足量)。
Si+CO2↑(碳不足)和__________________________________(碳足量)。
(2)经反应Ⅱ所得的四氯化硅粗品中所含的物质如下:
组分名称 | SiCl4 | SiHCl3 | SiH2Cl2 | HCl | BCl3 | PCl3 |
质量分数 | 0.545 | 0.405 | 0.0462 | 0.0003 | 0.00193 | 0.00157 |
沸点/℃ | 57.6 | 31.8 | 8.2 | -85 | 12.5 | 75.5 |
图中“操作X”的名称为______________________;PCl3的电子式为________________。
(3)反应IV的化学方程式为SiCl4+4NH3![]() Si3N4+12HCl,若向一2L恒容密闭容器中投入1molSiCl4和1molNH3,6min后反应完全,则0~6min内,HCl的平均反应速率为__________mol/(L·min)。反应III的与IV产生的气体相同,则反应III化学方程式为__________________。反应III中的原料气H2和O2在碱性条件下可构成燃料电池,其正极反应的电极方程式为__________________。
Si3N4+12HCl,若向一2L恒容密闭容器中投入1molSiCl4和1molNH3,6min后反应完全,则0~6min内,HCl的平均反应速率为__________mol/(L·min)。反应III的与IV产生的气体相同,则反应III化学方程式为__________________。反应III中的原料气H2和O2在碱性条件下可构成燃料电池,其正极反应的电极方程式为__________________。
【答案】碳(或C) 第三周期 ⅣA族 3C+SiO2![]() SiC+2CO↑ 精馏(或蒸馏或分馏)
SiC+2CO↑ 精馏(或蒸馏或分馏) ![]() 0.25 2H2+O2+SiCl4
0.25 2H2+O2+SiCl4![]() SiO2+4HCl O2+2H2O+4e-=4OH-
SiO2+4HCl O2+2H2O+4e-=4OH-
【解析】
(1)根据还原剂失去电子,元素的化合价升高;氧化剂获得电子,元素的化合价降低判断;根据原子核外电子排布与元素在周期表的位置分析;由于元素的非金属性C>Si,在高温下可能生成二者的化合物;
(2)得到的氯化物中各种成分的沸点相差较大,可利用蒸馏的方法提纯;P原子与3个Cl形成3对共用电子对结合形成PCl3;
(3)先利用化学反应速率定义式计算υ(NH3),然后根据υ(HCl)与υ(NH3)关系计算υ(HCl);根据框图可知反应物是SiCl4与H2、O2,生成物是SiO2、HCl,根据原子守恒、电子守恒书写反应的方程式;原料气H2和O2在碱性条件下可构成燃料电池,通入燃料H2的电极为负极,通入O2的电极为正极,根据原电池反应原理书写电极反应式。
(1)在反应2C+SiO2 ![]() Si+2CO↑中C元素的化合价由反应前的C单质的0价变为反应后CO中的+2价,化合价升高,失去电子,所以C为还原剂;Si是14号元素,Si原子核外K、L、M层依次排有2、8、4个电子,因此Si元素在元素周期表中位于第三周期第IVA族;在高温下,除可能发生副反应C+SiO2
Si+2CO↑中C元素的化合价由反应前的C单质的0价变为反应后CO中的+2价,化合价升高,失去电子,所以C为还原剂;Si是14号元素,Si原子核外K、L、M层依次排有2、8、4个电子,因此Si元素在元素周期表中位于第三周期第IVA族;在高温下,除可能发生副反应C+SiO2 ![]() Si+CO2↑外,足量的C与产生的Si再结合形成SiC,反应的方程式为:3C+SiO2
Si+CO2↑外,足量的C与产生的Si再结合形成SiC,反应的方程式为:3C+SiO2![]() SiC+2CO↑;
SiC+2CO↑;
(2)在用石英砂与焦炭反应产生的粗硅中含有Si及一些杂质,用氯气将这些物质氧化,得到各种氯化物的液态混合物,各种成分的沸点相差较大,可利用蒸馏法分离提纯得到纯净的SiCl4;P原子最外层有5个电子,Cl原子最外层有7个电子,P原子与3个Cl形成3对共用电子对结合形成PCl3,每个原子都达到最外层8个电子的稳定结构,所以其电子式为![]() ;
;
(3)在一个2L的密闭容器中进行反应SiCl4+4NH3![]() Si3N4+12HCl,开始时加入两种反应物的物质的量都是1mol,由于SiCl4与NH3以1:4物质的量之比参与反应,显然NH3完全反应,6min后反应完全,氨气全部反应,υ(NH3)=
Si3N4+12HCl,开始时加入两种反应物的物质的量都是1mol,由于SiCl4与NH3以1:4物质的量之比参与反应,显然NH3完全反应,6min后反应完全,氨气全部反应,υ(NH3)=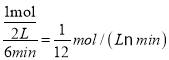 ,根据方程式中氨气与HCl的计量数关系可知υ(HCl)=3 υ(NH3)=3×
,根据方程式中氨气与HCl的计量数关系可知υ(HCl)=3 υ(NH3)=3×![]() =0.25mol/(Lmin);反应IV中产生的气体为HCl,SiCl4与H2、O2在高温下反应产生SiO2、HCl,反应的方程式是2H2+O2+SiCl4
=0.25mol/(Lmin);反应IV中产生的气体为HCl,SiCl4与H2、O2在高温下反应产生SiO2、HCl,反应的方程式是2H2+O2+SiCl4![]() SiO2+4HCl;反应III中的原料气H2和O2在碱性条件下可构成燃料电池,通入燃料H2的电极为负极,负极失去电子,发生氧化反应,通入O2的电极为正极,正极上获得电子,发生还原反应,由于电解质溶液为碱性,所以正极反应的电极方程式为O2+2H2O+4e-=4OH-。
SiO2+4HCl;反应III中的原料气H2和O2在碱性条件下可构成燃料电池,通入燃料H2的电极为负极,负极失去电子,发生氧化反应,通入O2的电极为正极,正极上获得电子,发生还原反应,由于电解质溶液为碱性,所以正极反应的电极方程式为O2+2H2O+4e-=4OH-。

 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案