题目内容
【题目】火力发电厂释放出大量氮氧化合物(NOx)、SO2和CO2等气体会造成环境问题。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:
CH4(g)+ 4NO2(g)=4NO(g)+ CO2(g)+ 2H2O(g) △H1=-574 kJ/mol
CH4(g)+ 4NO(g)=2N2(g)+ CO2(g)+ 2H2O(g) △H2=-1160 kJ/mol
甲烷直接将NO2还原为N2的热化学方程式为___________。
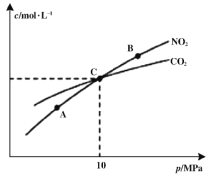
(2)脱碳。将CO2转化为甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3
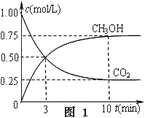

①在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2进行上述反应。测得CO2和CH3OH(g)浓度随时间变化如图1所示。回答:0~10 min内,氢气的平均反应速率为___mol/(L·min);第10 min后,保持温度不变,向该密闭容器中再充入1 mol CO2(g)和1 mol H2O(g),则平衡________(填“正向”、“逆向”或“不”)移动。
②如图2,25℃时以甲醇燃料电池(电解质溶液为稀硫酸)为电源来电解300mL 某NaCl溶液,正极反应式为______。在电解一段时间后,NaCl溶液的pH值变为13(假设NaCl溶液的体积不变),则理论上消耗甲醇的物质的量为_____mol。
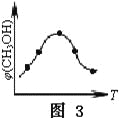
③取五份等体积的CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图3所示,则上述CO2转化为甲醇的反应的△H3____0(填“>”、“<”或“=”)。
(3)脱硫。燃煤废气经脱硝、脱碳后,与一定量氨气、空气反应,生成硫酸铵。硫酸铵水溶液呈酸性的原因是______(用离子方程式表示);室温时,向(NH4)2SO4,溶液中滴人NaOH溶液至溶液呈中性,则所得溶液中微粒浓度大小关系c(Na+)_____c(NH3·H2O)。(填“>”、“<”或“=”)
【答案】CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867 kJ/mol 0.225 正向 O2 + 4e-+ 4H+=2H2O 0.005 < NH4++H2O![]() NH3·H2O+H+ =
NH3·H2O+H+ =
【解析】
(1)已知:① CH4(g)+ 4NO2(g)=4NO(g)+ CO2(g)+ 2H2O(g) △H1=-574 kJ/mol,② CH4(g)+ 4NO(g)=2N2(g)+ CO2(g)+ 2H2O(g) △H2=-1160 kJ/mol,根据盖斯定律,将①+②相加除以2即得所求方程式,所以甲烷直接将NO2还原为N2的热化学方程式为CH4(g)+2NO2(g)=2(g)+CO2(g)+2H2O(g)△H=-867 kJ/mol。
(2)①由图1知甲醇的浓度在10min内增加0.75mol/L,所以氢气浓度减少3×0.75mol/L,0~10 min内,氢气的平均反应速率为3×0.75mol/L/10min="0.225" mol/(L·min);向该密闭容器中再充入1 mol CO2(g)和1 mol H2O(g),反应物浓度增大,平衡正向移动;
②正极发生还原反应,氧气得电子结合氢离子成为水,电极反应式为O2 + 4e-+ 4H+=2H2O;NaCl溶液的pH值变为13,说明c(NaOH)=0.1mol/L,其物质的量为0.03mol,说明生成氯气0.015mol,转移电子0.03mol,根据得失电子守恒,每消耗1mol甲醇的物质的量是0.005mol;
③图3的最高点意味着达平衡时甲醇的体积分数,随温度升高,甲醇体积分数减小,说明升温平衡逆向移动,所以正向为放热反应,△H3<0;
(3)硫酸铵水溶液呈酸性的原因是铵根离子水解使溶液显酸性,离子方程式为NH4++H2O![]() NH3·H2O+H+;室温时,向(NH4)2SO4,溶液中滴人NaOH溶液至溶液呈中性,则有c(OH-)=c(H+),根据电荷守恒,c(Na+)+c(H+)+c(NH4+)=c(OH-)+2c(SO42-),所以c(Na+)+c(NH4+)=2c(SO42-),再根据物料守恒得2c(SO42-)=c(NH4+)+c(NH3·H2O),两式结合可得c(Na+)=c(NH3·H2O)。
NH3·H2O+H+;室温时,向(NH4)2SO4,溶液中滴人NaOH溶液至溶液呈中性,则有c(OH-)=c(H+),根据电荷守恒,c(Na+)+c(H+)+c(NH4+)=c(OH-)+2c(SO42-),所以c(Na+)+c(NH4+)=2c(SO42-),再根据物料守恒得2c(SO42-)=c(NH4+)+c(NH3·H2O),两式结合可得c(Na+)=c(NH3·H2O)。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某兴趣小组研究含铁元素的盐类物质的制备、保存和性质。
实验I. 配制FeCl2溶液:向0.1 mol·L-1 FeCl3溶液中加入足量铁粉,充分振荡,备用。
(1)FeCl3溶液与铁粉反应的离子方程式是__________。
(2)在老师的指导下,配制的FeCl2溶液底部仍保留一层铁粉,请说明该操作的必要性__________。
实验II. 通过Fe(NO3)2的性质实验,探究试剂添加顺序的不同对现象和反应的影响。
实验 | 试剂及操作 | 现象 | |
试管 | 滴管 | ||
| 0.1 mol/L Fe(NO3)2溶液 | 实验i: 先滴加1.0 mL 0.5 mol·L-1 NaOH溶液; 再滴加1.5mL 1.0 mol·L-1 H2SO4溶液 | i. 滴加NaOH溶液后__________;加酸后溶液变为黄色 |
实验ii: 先滴加1.5 mL 1.0 mol·L-1 H2SO4溶液; 再滴加1.0 mL 0.5 mol·L-1 NaOH溶液 | ii. 加酸时溶液无明显现象;加碱后溶液依然没有明显变化 | ||
(3)实验i中滴加NaOH溶液后出现的一系列现象是__________;请用化学或离子方程式说明Fe(NO3)2溶液中滴加碱溶液后出现此系列现象的原因__________、__________。
(4)探究实验ii中先滴加H2SO4溶液时Fe(NO3)2溶液中是否发生了反应:
A. 向1.0 mL 0.1 mol·L-1 Fe(NO3)2溶液中__________(填写具体实验方法),溶液立即变红,说明加酸时溶液中发生了反应,生成了Fe3+。
B. 推测溶液中产生Fe3+的可能原因有两种:
a. 酸性条件下,__________;
b. 酸性条件下,Fe2+可能被空气中的O2氧化,写出相应的离子方程式:___________。
【题目】硫及其化合物有许多用途,相关物质的物理常数如表所示:
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
熔点/℃ | -85.5 | 115.2 | >600(分解) | -75.5 | 16.8 | 10.3 |
沸点/℃ | -60.3 | 444.6 | -10.0 | 45.0 | 337.0 |
回答下列问题:
(1)Fe在元素周期表的位置为__,基态S原子电子占据最高能级的电子云轮廓图为__形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是__。
(3)图a为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为___。
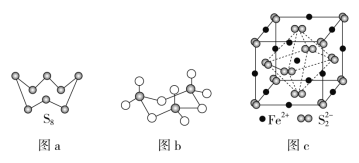
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为__形,其中共价键的类型有__种;固体三氧化硫中存在如图b所示的三聚分子,该分子中S原子的杂化轨道类型为__。
(5)FeS2晶体的晶胞如图c所示。晶胞边长为apm、FeS2的密度为ρg·cm-3,阿伏加德罗常数的值为NA,则FeS2的摩尔质量M的计算表达式为__g·mol-1;晶胞中Fe2+位于S22-所形成的正八面体的体心,该正八面体的边长为___pm。