题目内容
【题目】氮及其化合物是科学家们一直在探究的问题,它们在工农业生产和生命活动中起着重要的作用。回答下列问题。
I.NOx和SO2在空气中存在下列平衡:
2NO(g)+O2(g)2NO2(g)△H=﹣113.0kJmol﹣1
2SO2(g)+O2(g)2SO3(g)△H=﹣196.6kJmol﹣1
SO2通常在二氧化氮的存在下,进一步被氧化,生成SO3.
(1)写出NO2和SO2反应的热化学方程式为_________.
(2)随温度升高,该反应化学平衡常数变化趋势是_____.
II.(1)目前,应用NH3的催化还原法来进行烟气氮氧化物脱除,化学反应可表示为:2NH3(g)+NO(g)+NO2(g)== 2N2(g)+3H2O(g) △H<0,该反应中,反应物总能量_____(填“>”、“<”或“=”)生成物总能量。
(2)已知4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g) ΔH=-1800 kJ·mol-1,将2 mol NH3、3 mol NO的混合气体分别置于a、b、c三个10 L恒容密闭容器中,使反应在不同条件下进行,反应过程中c(N2)随时间的变化如图所示。
5N2(g)+6H2O(g) ΔH=-1800 kJ·mol-1,将2 mol NH3、3 mol NO的混合气体分别置于a、b、c三个10 L恒容密闭容器中,使反应在不同条件下进行,反应过程中c(N2)随时间的变化如图所示。
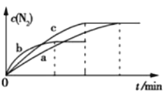
①与容器a中的反应相比,容器b中的反应改变的实验条件可能是_______,判断的依据是___________________。
②一定温度下,下列能说明反应已达到平衡状态的是____
A.H2O(g)与NO的生成速率相等 B.混合气体的密度保持不变
C.ΔH保持不变 D.容器的总压强保持不变
(3)用NH3和Cl2反应可以制备具有强氧化性的三氯胺(三氯胺在中性、酸性环境中会发生强烈水解,生成具有强杀菌作用的物质),方程式为3Cl2(g)+NH3(g)![]() NCl3(l)+3HCl(g),向容积均为1L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2molCl2和2molNH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
NCl3(l)+3HCl(g),向容积均为1L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2molCl2和2molNH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
t /min | 0 | 40 | 80 | 120 | 160 |
n(Cl2)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(Cl2)(乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①T℃__________400℃(填“>”或“<”)。
②该反应的ΔH__________0(填“>”或“<”)。
③该反应自发进行的条件是__________(填高温、低温、任何温度)。
④对该反应,下列说法正确的是_________(填选项字母)。
A.若容器内气体密度不变,则表明反应达到平衡状态
B.若容器内Cl2和NH3物质的量之比为3∶1,则表明反应达到平衡状态
C.反应达到平衡后,其他条件不变,在原容器中按![]() 继续充入一定量反应物,达新平衡后Cl2的转化率增大
继续充入一定量反应物,达新平衡后Cl2的转化率增大
D.反应达到平衡后,其他条件不变,加入一定量的NC13,平衡将向逆反应方向移动
【答案】NO2(g)+SO2(g)=SO3(g)+NO(g)△H=﹣41.8 kJmol﹣1 减小 > 升高温度 容器b中反应达到平衡所需时间比容器a短,且平衡时c(N2)也比容器a小,平衡逆向移动 AD > < 低温 AC
【解析】
I.(1)根据盖斯定律书写正确的热化学方程式;
(2)根据热化学方程式可知反应放热,升高温度,K值减小;
II.(1)放热反应:反应物的总能量大于生成物的总能量,吸热反应:反应物的总能量小于生成物的总能量;
(2)①由“先拐先平衡,数据大”进行判断;
②根据化学平衡的概念进行分析判断,当反应达到平衡状态时,正反应速率等于逆反应速率,且反应体系中所有参加反应的物质的质量或浓度保持恒定;
(3)①温度越高,反应速率越快,平衡向吸热方向移动,据此判断;
②温度升高,达到平衡时,氯气的物质的量增加,说明平衡逆向移动,由此分析;
③反应能自发进行,ΔG=ΔH-TΔS<0,由此判断;
④根据化学平衡的概念进行分析判断;
I.(1)①2NO(g)+O2(g)2NO2(g)△H=﹣113.0kJmol﹣1
②2SO2(g)+O2(g)2SO3(g)△H=﹣196.6kJmol﹣1
②-①得NO2(g)+SO2(g)=SO3(g)+NO(g)△H=﹣41.8 kJmol﹣1;
(2)该反应为放热反应,温度升高,平衡常数K减小;
II.(1)该反应为放热反应,反应物的总能量大于生成物的总能量;
(2)①与容器a中的反应相比,b达到平衡所需的时间缩短,氮气的浓度降低,说明平衡逆向移动,升高温度反应速率加快,平衡逆向移动,故容器b中的反应改变的实验条件可能是升高温度;
②A.生成H2O(g)为正向反应, 生成NO(g)为逆向反应,H2O(g)与NO的生成速率相等即v(正)=v(逆),反应达到平衡状态,A项正确;
B.根据质量守恒有混合气体的总质量不变,体积不变,所以混合气体的密度始终不变,不能证明反应达到平衡状态,B项错误;
C.反应热与平衡状态无关,C项错误;
D.该反应为非等体积反应,容器的总压强保持不变,说明反应达到了平衡状态,D项正确;
答案选AD;
(3)①温度越高,反应速率越快,T℃时的速率大于400℃时的反应速率,因此T℃>400℃
②温度升高,达到平衡时,氯气的物质的量增加,说明平衡逆向移动,即正向为放热反应,ΔH<0;
③该反应能自发进行,ΔG=ΔH-TΔS<0,由方程式知ΔS<0,又ΔH<0,那么当反应在低温下进行时,可以自发进行;
④A.该反应由气体生成了液体,反应前后气体的质量发生变化,容器体积不变,若气体的密度不变,证明反应达到了平衡状态,A项正确;
B.起始时容器中分别加入2molCl2和2molNH3,现容器内Cl2和NH3物质的量之比为3∶1,不能证明浓度不变,不能证明反应达到了平衡状态,B项错误;
C. 反应达到平衡后,其他条件不变,在原容器中按![]() ,相当于增大了压强,平衡正向移动,Cl2的转化率增大,C项正确;
,相当于增大了压强,平衡正向移动,Cl2的转化率增大,C项正确;
D.NCl3为液态,增加它的量对平衡的移动没有影响,D项错误;
答案选AC。

【题目】硫及其化合物有许多用途,相关物质的物理常数如表所示:
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
熔点/℃ | -85.5 | 115.2 | >600(分解) | -75.5 | 16.8 | 10.3 |
沸点/℃ | -60.3 | 444.6 | -10.0 | 45.0 | 337.0 |
回答下列问题:
(1)Fe在元素周期表的位置为__,基态S原子电子占据最高能级的电子云轮廓图为__形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是__。
(3)图a为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为___。
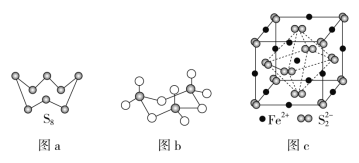
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为__形,其中共价键的类型有__种;固体三氧化硫中存在如图b所示的三聚分子,该分子中S原子的杂化轨道类型为__。
(5)FeS2晶体的晶胞如图c所示。晶胞边长为apm、FeS2的密度为ρg·cm-3,阿伏加德罗常数的值为NA,则FeS2的摩尔质量M的计算表达式为__g·mol-1;晶胞中Fe2+位于S22-所形成的正八面体的体心,该正八面体的边长为___pm。