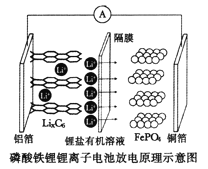
题目内容
【题目】常温下,实验测得1.0 mol·L-1 NH4HCO3溶液的 pH=8.0。平衡时碳的分布系数(各含碳微粒的浓度占含碳各种微粒浓度之和的分数)与pH的关系如图所示。下列说法正确的是

A. 常温下Ka1(H2CO3)>Kb(NH3·H2O)>Ka2(H2CO3)
B. pH=13时,溶液中不存在![]() 的水解平衡
的水解平衡
C. pH由8~11时, ![]() 不变
不变
D. pH=3时,有c(![]() )+c(NH3·H2O)=c(
)+c(NH3·H2O)=c(![]() )+c(
)+c(![]() )+c(H2CO3)
)+c(H2CO3)
【答案】C
【解析】
A、1.0mol/L NH4HCO3溶液pH=8.0,说明铵根水解程度小于碳酸氢根离子,根据盐类越弱越水解的原理分析;
B、据图象分析,pH=13时仍有HCO3-;
C、![]() 为HCO3-的电离平衡常数表达式,其大小只受温度影响;
为HCO3-的电离平衡常数表达式,其大小只受温度影响;
D、pH=3时,NH4HCO3会与氢离子反应生成二氧化碳。
A、根据越弱越水解原理,1.0mol/L NH4HCO3溶液pH=8.0,说明铵根水解程度小于碳酸氢根离子,应有Kb(NH3H2O)>Ka(H2CO3)>Ka2(H2CO3),选项A错误;
B、只要存在碳酸氢根离子就存在HC03-的水解平衡,选项B错误;
C、温度不变,碳酸氢根离子的电离平衡常数不变,选项C正确;
D、pH=3时,NH4HCO3会与氢离子反应生成二氧化碳,所以c(NH4+)+c(NH3H2O)>c(HCO3-)+c(CO32-)+c(H2CO3),选项D错误;
答案选C。

 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案【题目】硫及其化合物有许多用途,相关物质的物理常数如表所示:
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
熔点/℃ | -85.5 | 115.2 | >600(分解) | -75.5 | 16.8 | 10.3 |
沸点/℃ | -60.3 | 444.6 | -10.0 | 45.0 | 337.0 |
回答下列问题:
(1)Fe在元素周期表的位置为__,基态S原子电子占据最高能级的电子云轮廓图为__形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是__。
(3)图a为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为___。
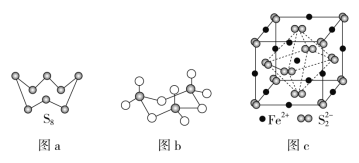
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为__形,其中共价键的类型有__种;固体三氧化硫中存在如图b所示的三聚分子,该分子中S原子的杂化轨道类型为__。
(5)FeS2晶体的晶胞如图c所示。晶胞边长为apm、FeS2的密度为ρg·cm-3,阿伏加德罗常数的值为NA,则FeS2的摩尔质量M的计算表达式为__g·mol-1;晶胞中Fe2+位于S22-所形成的正八面体的体心,该正八面体的边长为___pm。