题目内容
10. 已知t℃、p kPa时,在容器甲和容器乙中分别充入1 mol A(g)和1 mol B(g),发生反应A(g)+B(g)?C(g)△H<0,反应过程中温度保持不变.已知起始时V乙=$\frac{5}{7}$V甲,装置如图所示,当反应达平衡时,测得甲中C的体积分数为40%,下列说法不正确的是( )
已知t℃、p kPa时,在容器甲和容器乙中分别充入1 mol A(g)和1 mol B(g),发生反应A(g)+B(g)?C(g)△H<0,反应过程中温度保持不变.已知起始时V乙=$\frac{5}{7}$V甲,装置如图所示,当反应达平衡时,测得甲中C的体积分数为40%,下列说法不正确的是( )| A. | 容器甲乙中反应的平衡常数相等 | |
| B. | 容器甲乙中反应的起始速率不等 | |
| C. | 达平衡时,容器甲、乙中各组分的体积分数不等 | |
| D. | 达平衡时,容器甲、乙中放出的热量相等 |
分析 A、平衡常数仅与温度有关;
B、起始速率与起始反应物浓度成正比;
C、甲为恒压,乙为恒容,根据反应A(g)+B(g)?C(g)△H<0,则甲相对于乙增大压强;
D、甲为恒压,乙为恒容,根据反应A(g)+B(g)?C(g)△H<0,则甲相对于乙增大压强.
解答 解:A、因为平衡常数仅与温度有关,又反应过程中温度保持不变,所以容器甲乙中反应的平衡常数相等,故A正确;
B、因为在容器甲和容器乙中分别充入1 mol A(g)和1 mol B(g),起始时V乙=$\frac{5}{7}$V甲,所以起始时甲中反应物浓度小于乙,则容器甲乙中反应的起始速率不等,故B正确;
C、甲为恒压,乙为恒容,根据反应A(g)+B(g)?C(g)△H<0,则甲相对于乙增大压强,所以甲中反应物转换率大于乙,则达平衡时,容器甲、乙中各组分的体积分数不等,故C正确;
D、甲为恒压,乙为恒容,根据反应A(g)+B(g)?C(g)△H<0,则甲相对于乙增大压强,所以甲中反应物转换率大于乙,则达平衡时,容器甲、乙中放出的热量甲大于乙,故D错误;
故选D.
点评 本题综合考查恒温恒压,恒温恒容容器中影响化学反应速率,平衡常数的判断,化学平衡的影响因素分析判断,题目难度中等.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目
20.某恒温密闭容器中,可逆反应A(s)?B+C(g)△H=+Q kJ•mol-1(Q>0)达到平衡.缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等.以下分析不正确的是( )
| A. | 产物B的状态只能为固态或液态 | |
| B. | 平衡时,单位时间内n(A)消耗﹕n(C)消耗=1﹕1 | |
| C. | 若开始时向容器中加入1molB和1molC,达到平衡时放出热量小于Q kJ | |
| D. | 保持体积不变,向平衡体系中加入B,平衡可能向逆反应方向移动 |
1.原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关.下列说法中正确的是( )


| A. | ①②中Mg作负极,③④中Fe作负极 | |
| B. | ②中Mg作正极,电极反应式为:2H2O+2e-═2OH-+H2↑ | |
| C. | ③中Fe作负极,电极反应式为Fe-2e-═Fe2+ | |
| D. | ④中Cu作正极,电极反应式为2H++2e-═H2↑ |
18.镁橄榄石(MgO•2SiO2)中的阴离子是( )
| A. | SiO32- | B. | Si2O52- | C. | SiO44- | D. | Si4O104- |
19.下列说法不正确的是( )
| A. | Al箔插入稀HNO3中无现象因Al箔表面被HNO3氧化,形成致密的氧化膜 | |
| B. | 如图所示,①为AlCl3溶液,②中为浓氨水,①中有白色沉淀生成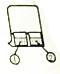 | |
| C. | Al2O3$\stackrel{NaOH(aq)}{→}$NaAlO2(aq)→Al(OH)3 | |
| D. | AlCl3溶液中滴加NaOH后铝元素的存在形式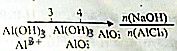 |
18.现有7瓶失去了标签的液体,可能是:①乙醇,②乙酸,③苯,④乙酸乙酯,⑤油脂,⑥葡萄糖溶液,⑦蔗糖溶液.现通过如表实验步骤来确定各试剂瓶中所装的液体名称.
试给它们的试剂瓶重新贴上标签:
B乙酸,D乙酸乙酯,E油脂,F葡萄糖,G蔗糖溶液.
| 实验步骤和方法 | 实验现象 |
| 1.把7瓶液体分别依次标号A、B、C、D、E、F、G后闻气味 | 只有F、G两种液体没有气味 |
| 2.各取少量于试管中加水稀释 | 只有C、D、E三种液体不溶解而浮在水上层 |
| 3.分别取少量7种液体于试管中加新制的Cu(OH)2悬浊液并加热 | 只有B使沉淀溶解,F中产生砖红色沉淀 |
| 4.各取C、D、E少量于试管中,加稀NaOH溶液并加热 | 只有C仍有分层现象,且E中发生了皂化反应 |
B乙酸,D乙酸乙酯,E油脂,F葡萄糖,G蔗糖溶液.