题目内容
19.下列说法不正确的是( )| A. | Al箔插入稀HNO3中无现象因Al箔表面被HNO3氧化,形成致密的氧化膜 | |
| B. | 如图所示,①为AlCl3溶液,②中为浓氨水,①中有白色沉淀生成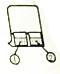 | |
| C. | Al2O3$\stackrel{NaOH(aq)}{→}$NaAlO2(aq)→Al(OH)3 | |
| D. | AlCl3溶液中滴加NaOH后铝元素的存在形式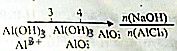 |
分析 A.Al与稀硝酸不发生钝化;
B.浓氨水具有挥发性,挥发出的氨气属于碱性气体溶于水形成一水合氨,一水合氨和氯化铝反应生成氢氧化铝沉淀;
C.氧化铝能够与氢氧化钠溶液反应生成偏铝酸钠,偏铝酸钠能够与二氧化碳气体反应生成氢氧化铝沉淀;
D.氢氧化钠与氯化铝的物质的量为3:1时恰好生成氢氧化铝沉淀,当二者之比为4:1时铝离子完全转化成偏铝酸根离子.
解答 解:A.Al与稀硝酸不发生钝化,与浓硝酸在常温下发生钝化,则Al箔插入稀HNO3中金属溶解,有气泡冒出,故A错误;
B.浓氨水具有挥发性,挥发出的氨气属于碱性气体溶于水形成一水合氨,一水合氨和氯化铝反应生成氢氧化铝沉淀:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,所以,①中有白色沉淀生成,故B正确;
C.氧化铝为两性氧化物,能够与氢氧化钠溶液反应生成偏铝酸钠,偏铝酸钠溶液能够与二氧化碳反应生成氢氧化铝沉淀,所以该转化关系能够实现,故C正确;
D.OH-与Al3+的物质的量之比为3:1时,铝元素都以Al(OH)3的形式存在,即OH-与Al3+的物质的量之比为≤3时铝元素都以Al(OH)3和Al3+的形式存在,OH-与Al3+的物质的量之比为4:1时,铝元素都以AlO2-的形式存在,即OH-与Al3+的物质的量之比为≥4时铝元素都以AlO2-的形式存在,故D正确;
故选A.
点评 本题考查了铝单质及其化合物性质,题目难度中等,明确铝及其化合物性质为解答关键,注意掌握铝与浓硫酸、浓硝酸的钝化现象及氧化铝、氢氧化铝的化学性质,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
9.原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关.下列说法中不正确的是( )
| A. | 由Fe、Cu、FeCl3溶液组成原电池,负极反应式为:Cu-2e-═Cu2+ | |
| B. | 由Al、Cu、稀硫酸组成原电池,负极反应式为:Al-3e-═Al3+ | |
| C. | 由Al、Mg、NaOH溶液组成原电池,负极反应式为:Al+4OH--3e-═AlO2-+2H2O | |
| D. | 由Al、Cu、浓硝酸组成的原电池中,负极反应式为:Cu-2e-═Cu2+ |
10. 已知t℃、p kPa时,在容器甲和容器乙中分别充入1 mol A(g)和1 mol B(g),发生反应A(g)+B(g)?C(g)△H<0,反应过程中温度保持不变.已知起始时V乙=$\frac{5}{7}$V甲,装置如图所示,当反应达平衡时,测得甲中C的体积分数为40%,下列说法不正确的是( )
已知t℃、p kPa时,在容器甲和容器乙中分别充入1 mol A(g)和1 mol B(g),发生反应A(g)+B(g)?C(g)△H<0,反应过程中温度保持不变.已知起始时V乙=$\frac{5}{7}$V甲,装置如图所示,当反应达平衡时,测得甲中C的体积分数为40%,下列说法不正确的是( )
 已知t℃、p kPa时,在容器甲和容器乙中分别充入1 mol A(g)和1 mol B(g),发生反应A(g)+B(g)?C(g)△H<0,反应过程中温度保持不变.已知起始时V乙=$\frac{5}{7}$V甲,装置如图所示,当反应达平衡时,测得甲中C的体积分数为40%,下列说法不正确的是( )
已知t℃、p kPa时,在容器甲和容器乙中分别充入1 mol A(g)和1 mol B(g),发生反应A(g)+B(g)?C(g)△H<0,反应过程中温度保持不变.已知起始时V乙=$\frac{5}{7}$V甲,装置如图所示,当反应达平衡时,测得甲中C的体积分数为40%,下列说法不正确的是( )| A. | 容器甲乙中反应的平衡常数相等 | |
| B. | 容器甲乙中反应的起始速率不等 | |
| C. | 达平衡时,容器甲、乙中各组分的体积分数不等 | |
| D. | 达平衡时,容器甲、乙中放出的热量相等 |
9.“低碳循环”已引起各国家的高度重视,而如何降低大气中CO2的含量和有效地开发利用CO2,引起了全世界的普遍重视.所以“低碳经济”正成为科学家研究的主要课题.
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
5 C+4 KMnO4+6 H2SO4→5CO2↑+4MnSO4+2K2SO4+6H2O;
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
①实验1条件下平衡常数K=2.67(取小数二位,下同);
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b 的值<1 (填具体值或取值范围);
③实验4,若900℃时,在此容器中加入10molCO,5molH2O,2molCO2,5molH2,则此时V正<V逆(填“<”、“>”或“=”).
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
5 C+4 KMnO4+6 H2SO4→5CO2↑+4MnSO4+2K2SO4+6H2O;
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b 的值<1 (填具体值或取值范围);
③实验4,若900℃时,在此容器中加入10molCO,5molH2O,2molCO2,5molH2,则此时V正<V逆(填“<”、“>”或“=”).
6.在100℃时,将0.10mol的N2O4气体充入1L抽空的密闭容器中,隔一定时间对该容器内的物质进行分析,得到如下表格数据:
试填空:
(1)该反应的化学方程式为N2O4?2 NO2,达到平衡时N2O4的转化率为60%,表中c2>c3,a=b(填“>”、“<”或“=”).
(2)20s时,N2O4的浓度c1=0.07mol/L,在0~20s内N2O4的平均反应速率为0.0015mol•(L•s)-1.
(3)若在相同情况下最初向该容器中充入的是NO2气体,则要达到上述同样的平衡状态,NO2的起始浓度是0.2mol/L.
| 时间/s 浓度(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4) | 0.10 | c1 | 0.05 | c3 | a | b |
| c(NO2) | 0.00 | 0.06 | c2 | 0.12 | 0.12 | 0.12 |
(1)该反应的化学方程式为N2O4?2 NO2,达到平衡时N2O4的转化率为60%,表中c2>c3,a=b(填“>”、“<”或“=”).
(2)20s时,N2O4的浓度c1=0.07mol/L,在0~20s内N2O4的平均反应速率为0.0015mol•(L•s)-1.
(3)若在相同情况下最初向该容器中充入的是NO2气体,则要达到上述同样的平衡状态,NO2的起始浓度是0.2mol/L.
7.将0.2moL AgNO3、0.4moLCu(NO3)2、0.6moLKCl溶于水,配成100mL的溶液,用石墨做电极电解一段时间后,在一极析出0.3moLCu,此时在另一极收集到气体体积为(标况)( )
| A. | 4.48L | B. | 5.6L | C. | 6.72L | D. | 7.84L |