题目内容
1.原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关.下列说法中正确的是( )
| A. | ①②中Mg作负极,③④中Fe作负极 | |
| B. | ②中Mg作正极,电极反应式为:2H2O+2e-═2OH-+H2↑ | |
| C. | ③中Fe作负极,电极反应式为Fe-2e-═Fe2+ | |
| D. | ④中Cu作正极,电极反应式为2H++2e-═H2↑ |
分析 A、根据氧化还原反应,失电子的极是负极;
B、原电池的正极发生得电子的还原反应;
C、铜作负极发生氧化反应;
D、铁、铜、氯化钠构成的原电池中,金属铁发生的是吸氧腐蚀.
解答 解:A、②中的氧化还原反应发生在金属铝和氢氧化钠之间,失电子的是金属铝,为负极,③中金属铁在常温下遇浓硝酸钝化,不能形成原电池,故A错误;
B、②中的氧化还原反应发生在金属铝和氢氧化钠之间,失电子的是金属铝,为负极,Mg作为正极,电极反应式为2H2O+2e-═2OH-+H2↑,故B正确;
C、③中铜作负极发生氧化反应,所以铜失电子生成铜离子,即电极反应式为Cu-2e-═Cu2+,故C错误;
D、铁、铜、氯化钠构成的原电池中,金属铁为负极,金属铜为正极,铁发生的是吸氧腐蚀,正极上是氧气得电子的过程,故D错误.
故选B.
点评 本题考查学生原电池的工作原理知识,电极的活泼性与电解质溶液有关,如镁和铝在氢氧化钠溶液中铝活泼而铁与铜在冷的浓硫酸和浓硝酸中铜活泼,难度不大.

练习册系列答案
相关题目
11.下列有关醛的判断正确的是( )
| A. | 用溴水检验CH2=CH-CHO中是否含有碳碳双键 | |
| B. | 1mol醛发生银镜反应最多生成2molAg | |
| C. | 对甲基苯甲醛( )使高锰酸钾酸性溶液褪色,说明它含醛基 )使高锰酸钾酸性溶液褪色,说明它含醛基 | |
| D. | 能发生银镜反应的有机物不一定是醛类 |
12.下列变化过程中△H<0的是( )
| A. | Na与水反应 | B. | HCl分解为H2和Cl2 | ||
| C. | 电解Al2O3得到Al和O2 | D. | Ba(OH)2•8H2O与NH4Cl晶体混合反应 |
9.原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关.下列说法中不正确的是( )
| A. | 由Fe、Cu、FeCl3溶液组成原电池,负极反应式为:Cu-2e-═Cu2+ | |
| B. | 由Al、Cu、稀硫酸组成原电池,负极反应式为:Al-3e-═Al3+ | |
| C. | 由Al、Mg、NaOH溶液组成原电池,负极反应式为:Al+4OH--3e-═AlO2-+2H2O | |
| D. | 由Al、Cu、浓硝酸组成的原电池中,负极反应式为:Cu-2e-═Cu2+ |
16.化学方程式正确的是( )
| A. | CH3CH═CH2+Br2(水溶液)-→CH2BrCH═CH2+HBr | |
| B. | nCH3CH═CH2$\stackrel{一定条件下}{→}$[CH3-CH-CH2]n | |
| C. | CH2═CH-CH═CH2+Br2-→CH2Br2-CH═CH-CH3 | |
| D. | CH3CH2OH$\stackrel{浓H_{2}SO_{4}}{→}$CH2═CH2↑+H2O |
13.下列实验事实能用同一原理解释的是( )
| A. | SO2、Cl2均能使品红溶液褪色 | |
| B. | NH4Cl晶体、固态碘受热时均能变成气体 | |
| C. | 苯酚,乙烯均能使溴水褪色 | |
| D. | 福尔马林,葡萄糖与新制的Cu(OH)2共热均有红色沉淀 |
10. 已知t℃、p kPa时,在容器甲和容器乙中分别充入1 mol A(g)和1 mol B(g),发生反应A(g)+B(g)?C(g)△H<0,反应过程中温度保持不变.已知起始时V乙=$\frac{5}{7}$V甲,装置如图所示,当反应达平衡时,测得甲中C的体积分数为40%,下列说法不正确的是( )
已知t℃、p kPa时,在容器甲和容器乙中分别充入1 mol A(g)和1 mol B(g),发生反应A(g)+B(g)?C(g)△H<0,反应过程中温度保持不变.已知起始时V乙=$\frac{5}{7}$V甲,装置如图所示,当反应达平衡时,测得甲中C的体积分数为40%,下列说法不正确的是( )
 已知t℃、p kPa时,在容器甲和容器乙中分别充入1 mol A(g)和1 mol B(g),发生反应A(g)+B(g)?C(g)△H<0,反应过程中温度保持不变.已知起始时V乙=$\frac{5}{7}$V甲,装置如图所示,当反应达平衡时,测得甲中C的体积分数为40%,下列说法不正确的是( )
已知t℃、p kPa时,在容器甲和容器乙中分别充入1 mol A(g)和1 mol B(g),发生反应A(g)+B(g)?C(g)△H<0,反应过程中温度保持不变.已知起始时V乙=$\frac{5}{7}$V甲,装置如图所示,当反应达平衡时,测得甲中C的体积分数为40%,下列说法不正确的是( )| A. | 容器甲乙中反应的平衡常数相等 | |
| B. | 容器甲乙中反应的起始速率不等 | |
| C. | 达平衡时,容器甲、乙中各组分的体积分数不等 | |
| D. | 达平衡时,容器甲、乙中放出的热量相等 |
9.“低碳循环”已引起各国家的高度重视,而如何降低大气中CO2的含量和有效地开发利用CO2,引起了全世界的普遍重视.所以“低碳经济”正成为科学家研究的主要课题.
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
5 C+4 KMnO4+6 H2SO4→5CO2↑+4MnSO4+2K2SO4+6H2O;
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
①实验1条件下平衡常数K=2.67(取小数二位,下同);
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b 的值<1 (填具体值或取值范围);
③实验4,若900℃时,在此容器中加入10molCO,5molH2O,2molCO2,5molH2,则此时V正<V逆(填“<”、“>”或“=”).
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
5 C+4 KMnO4+6 H2SO4→5CO2↑+4MnSO4+2K2SO4+6H2O;
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b 的值<1 (填具体值或取值范围);
③实验4,若900℃时,在此容器中加入10molCO,5molH2O,2molCO2,5molH2,则此时V正<V逆(填“<”、“>”或“=”).
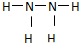 ,过氧化氢的电子式
,过氧化氢的电子式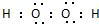 .
.