题目内容
15.小苏打、胃舒平、达喜都是常用的中和胃酸的药物.(1)小苏打片每片含0.42 gNaHCO3,2片小苏打片和胃酸完全反应(中和),被反应(中和)的氢离子的物质的量是多少?
(2)胃舒平每片含0.234 g Al(OH)3.中和胃酸时,1片小苏打片相当于胃舒平多少片?
(3)某化学成分是可溶性的碱式碳酸盐的胃酸药物,表示为My(OH)zCO3•4H2O,其中M代表某金属元素.取该碱式盐若干,逐滴加入某浓度的盐酸使其溶解,当加入盐酸42.5 mL时开始产生CO2,加入盐酸至45.0mL时正好反应完全,计算该碱式盐样品中氢氧根与碳酸根的物质的量之比(即z的值).
(已知:OH-优先于CO32-与H+反应)
分析 (1)发生反应:NaHCO3+HCl=NaCl+H2O+CO2↑,根据方程式计算2片小苏打片和胃酸完全反应被反应(中和)的氢离子的物质的量;
(2)计算1片小苏打可以中和氢离子物质的量,再根据Al(OH)3+3HCl=AlCl3+3H2O计算氢氧化铝消耗氢离子的物质的量,最后根据消耗的氢离子的物质的量之比计算1片小苏打片相当于胃舒平的片数;
(3)加入盐酸生成二氧化碳,可知该药物为铝和镁的碱式碳酸盐,反应过程为:先发生H++OH-═H2O,再发生CO32-+H+═HCO3-,最后发生HCO3-+H+═CO2↑+H2O,从42.5mL~45.0mL消耗2.5mL盐酸,发生反应HCO3-+H+═CO2↑+H2O,根据方程式计算n(HCO3-)、n(CO32-),进而计算HCO3-、CO32-消耗的氢离子物质的量,进而计算n(OH-),据此解答.
解答 解:(1)2片小苏打片中含有碳酸氢钠的质量为:0.42g×2=0.84g,
设被中和的HCl物质的量为n(HCl),
NaHCO3 +HCl=NaCl+H2O+CO2↑
84g 1mol
0.84g n(HCl)
n(HCl)=$\frac{1mol×0.84g}{84g}$=0.01mol,
则n(H+)=n(HCl)=0.01mol,
答:被反应(中和)的氢离子的物质的量为0.012;
(2)0.234g氢氧化铝的物质的量为:$\frac{0.234g}{78g/mol}$=0.003mol,
1片小苏打可以中和氢离子物质的量=0.01mol×$\frac{1}{2}$=0.005mol,即可以中和HCl为0.005mol,
Al(OH)3+3HCl=AlCl3+3H2O
1 3
0.003 x
x=$\frac{0.003mol×3}{1}$=0.009mol
1片小苏打片相当于胃舒平的片数为:$\frac{0.005mol}{0.009mol}$=0.56,
答:1片小苏打片相当于胃舒平0.56片;
(3)加入盐酸生成二氧化碳,可知该药物为铝和镁的碱式碳酸盐,反应过程为:先发生H++OH-═H2O,再发生CO32-+H+═HCO3-,最后发生HCO3-+H+═CO2↑+H2O,
从42.5mL~45.0mL消耗2.5mL盐酸,其物质的量=0.0025L×2mol/L=0.005mol,则:
HCO3-+H+═CO2↑+H2O,
0.005mol 0.005mol
CO32-+H+═HCO3-
0.005mol 0.005mol 0.005mol
故与氢氧根反应的氢离子的物质的量为:0.045L×2mol/L-0.005mol-0.005mol=0.08mol,则:
H++OH-═H2O
0.08mol 0.08mol
故该碱式盐样品中氢氧根与碳酸根的物质的量之比为:0.08mol:0.005mol=16:1,
答:该碱式盐样品中氢氧根与碳酸根的物质的量之比为16:1.
点评 本题考查化学方程式的基本计算,题目难度中等,解答关键是正确写出化学方程式,试题体现了化学在生活中的应用,有利于培养学生的分析、理解能力及化学计算能力.

 名校课堂系列答案
名校课堂系列答案| A. | ${\;}_{18}^{35}$Cl- | B. | ${\;}_{17}^{35}$Cl | C. | ${\;}_{19}^{35}$Cl- | D. | ${\;}_{17}^{35}$Cl- |
 已知t℃、p kPa时,在容器甲和容器乙中分别充入1 mol A(g)和1 mol B(g),发生反应A(g)+B(g)?C(g)△H<0,反应过程中温度保持不变.已知起始时V乙=$\frac{5}{7}$V甲,装置如图所示,当反应达平衡时,测得甲中C的体积分数为40%,下列说法不正确的是( )
已知t℃、p kPa时,在容器甲和容器乙中分别充入1 mol A(g)和1 mol B(g),发生反应A(g)+B(g)?C(g)△H<0,反应过程中温度保持不变.已知起始时V乙=$\frac{5}{7}$V甲,装置如图所示,当反应达平衡时,测得甲中C的体积分数为40%,下列说法不正确的是( )| A. | 容器甲乙中反应的平衡常数相等 | |
| B. | 容器甲乙中反应的起始速率不等 | |
| C. | 达平衡时,容器甲、乙中各组分的体积分数不等 | |
| D. | 达平衡时,容器甲、乙中放出的热量相等 |
| A. | pH=6的H2S溶液中,c(H+)=c(HS-)=1×10-6mol•L-1 | |
| B. | pH=a的醋酸溶液,稀释10倍后,其pH=b,则b=a+1 | |
| C. | pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合后,溶液pH<7:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) | |
| D. | pH相同的①CH3COONa、②Na2CO3、③NaClO三种溶液的c(Na+):①<②<③ |
(1)下列是某同学对有关物质进行分类的列表:
| 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
| 第一组 | Na2CO3 | H2SO4 | NaHCO3 | CaO | CO2 |
| 第二组 | NaOH | HCl | NaCl | Na2O | SO2 |
| 第三组 | NaOH | CH3COOOH | CaF2 | Al2O3 | SO2 |
(2)下列2个反应,按要求填写相关量.
①2Na2O2+2H2O=4NaOH+O2反应中,每消耗lmol Na2O2生成16g O2;
②除去NaCl溶液中少量的Na2SO4杂质,要判断所加BaCl2溶液是否过量,可向滤液中加入X溶液,X可以是D(填代号)
A.NaOH B.AgNO3 C.HCl D.Na2SO4
(3)配平下面化学方程式,回答下列问题:
3C+2K2Cr2O7+8H2SO4═2K2SO4+3CO2↑+2Cr2(SO4)3+8H2O
①H2SO4在上述反应中表现出来的性质是(填选项编号)C.
A.氧化性 B.氧化性和酸性 C.酸性 D.还原性和酸性
②若反应中电子转移了0.8mol,则产生的气体在标准状况下的体积为4.48L.
(4)在一个密闭容器中放入M、N、Q、P四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表,按要求回答下列问题:
| 物质 | M | N | Q | P |
| 反应前质量(g) | 50 | 1 | 3 | 12 |
| 反应后质量(g) | X | 26 | 3 | 30 |
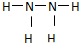 ,过氧化氢的电子式
,过氧化氢的电子式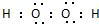 .
.
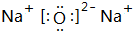 ,C的化学式Cl2.
,C的化学式Cl2.