题目内容
对常温下pH=3的CH3COOH溶液,下列叙述不正确的是
A.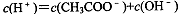 |
| B.加入少量CH3COONa固体后,c(CH3COO—)降低 |
| C.该溶液中由水电离出的c(H+)是1.0×10-11 mol/L |
| D.与等体积pH =11的NaOH溶液混合后所得溶液显酸性 |
B
解析试题分析:A、根据电荷守恒,可得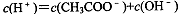 ,正确;B、加入少量CH3COONa固体后,尽管醋酸的电离平衡逆向移动,但c(CH3COO—)升高,错误;C、pH=3的CH3COOH溶液,c(H+)=0.001mol/L,则c(OH-)= 1.0×10-11 mol/L,水电离的c(H+)= c(OH-)= 1.0×10-11 mol/L,正确;D、pH=3的CH3COOH溶液与等体积pH =11的NaOH溶液混合,醋酸的浓度大于氢氧化钠溶液的浓度,所以混合后醋酸过量,溶液呈酸性,正确,答案选B。
,正确;B、加入少量CH3COONa固体后,尽管醋酸的电离平衡逆向移动,但c(CH3COO—)升高,错误;C、pH=3的CH3COOH溶液,c(H+)=0.001mol/L,则c(OH-)= 1.0×10-11 mol/L,水电离的c(H+)= c(OH-)= 1.0×10-11 mol/L,正确;D、pH=3的CH3COOH溶液与等体积pH =11的NaOH溶液混合,醋酸的浓度大于氢氧化钠溶液的浓度,所以混合后醋酸过量,溶液呈酸性,正确,答案选B。
考点:考查弱电解质的电离平衡,平衡移动,溶液酸碱性的判断,水电离的氢离子浓度的计算

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案
相关题目
在相同的条件下测得①NaHCO3 ②CH3COONa ③NaClO三种溶液pH相同,则它们的物质的量浓度由大到小的顺序是
| A.①>②>③ | B.③>②>① | C.②>①>③ | D.③>①>② |
50℃时,下列各溶液中,离子的物质的量浓度关系正确的是
| A.pH=4的醋酸中:c(H+)=4.0mol·L-1 |
| B.饱和小苏打溶液中:c(Na+)= c(HCO3-) |
| C.饱和食盐水中:c(Na+)+ c(H+)= c(Cl-)+c(OH-) |
| D.pH=12的纯碱溶液中:c(OH-)=1.0×10-2mol·L-1 |
水是生命之源,2014年我国科学家首次拍摄到水分子团簇的空间取向图像,模型如图。下列关于水的说法正确的是
| A.水是弱电解质 | B.可燃冰是可以燃烧的水 |
| C.氢氧两种元素只能组成水 | D.0℃时冰的密度比液态水的密度大 |
下列说法正确的是
| A.0.1 mol/L溶液中的(NH4)2SO4溶液中的c(NH4+)<c(SO42-) |
| B.相同温度下,0.6 mol/L氨水溶液与0.3 mol/L氨水溶液中c(OH-)之比是2∶1 |
| C.向0.1 mol/L NaNO3溶液中滴加硝酸使溶液pH=5,此时混合液中的c(Na+)<c(NO3-) |
| D.向醋酸钠溶液中加入适量醋酸,使混合液pH=7,此时混合液中c(Na+)<c(CH3COO-) |
下列溶液中离子浓度的关系一定正确的是
A. 和 和 溶液中: 溶液中: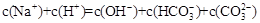 |
B.一元弱碱MOH对应的盐MCl溶液中: |
C.等物质的量的一元弱酸HX与其钾盐KX的混合溶液中: |
D.pH=3的一元酸HX和pH=11的一元碱MOH等体积混合: |
草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol/LNaHC2O4溶液中滴加0.01 mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是
| A.V(NaOH)=0时,c(H+)=1×10-2mol/L |
| B.V(NaOH)<10mL时,不可能存在c(Na+)=2c(C2O42-)+c(HC2O4-) |
| C.V(NaOH)=10mL时,c(H+)=1×10-7mol/L |
| D.V(NaOH)>10mL时,c(Na+)>c(C2O42-)>c(HC2O4-) |
常温下,向l00mL 0.01 mol?L-1盐酸中逐滴加入0.02 mol?L-1 MOH溶液,如下图所示,曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法中不正确的是( )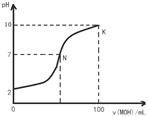
| A.MOH是弱碱 |
| B.N点c(Cl-) = c(M+) |
C.随着MOH溶液的滴加,比值 不变 不变 |
| D.K点对应的溶液c(MOH)+c(OH-)-c(H+) = 0.005 mol?L-1 |