题目内容
常温下,向l00mL 0.01 mol?L-1盐酸中逐滴加入0.02 mol?L-1 MOH溶液,如下图所示,曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法中不正确的是( )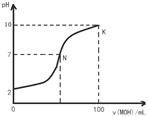
| A.MOH是弱碱 |
| B.N点c(Cl-) = c(M+) |
C.随着MOH溶液的滴加,比值 不变 不变 |
| D.K点对应的溶液c(MOH)+c(OH-)-c(H+) = 0.005 mol?L-1 |
D
解析试题分析:A. 若MOH为强碱,则在恰好完全中和前后溶液的pH应该有一个很大的突越。,但是该图的pH在恰好中和时变化不明显。因此MOH为弱碱。正确。B.根据电荷守恒可得c(Cl-)+c(OH-) = c(H+)+c(M+),而在N点的溶液中c(OH-) = c(H+),所以N点c(Cl-) = c(M+)。正确。C.随着MOH溶液的滴加,c(M+)、c(OH-)不断增大,在恰好完全中和前, c(MOH)逐渐减小,因此c(M+)·c(OH-)/ c(MOH)比值逐渐增大。错误。D.在K点根据电荷守恒可得c(H+)+c(M+)=c(OH-)+c(Cl-);根据物料守恒可得c(M+)+ c(MOH) =0.01 mol/L;c(Cl-)=0.005mol/L,所以c(M+)=c(OH-)+c(Cl-)- c(H+),c(M+)+ c(MOH)= c(OH-)+c(Cl-)- c(H+)+ c(MOH),c(MOH)+c(OH-)-c(H+) = 0.01mol/L-0.005mol/L=0.005mol/L。正确。
考点:考查酸碱中和反应中离子浓度的大小比较、物质的强弱的判断及离子浓度的关系的知识。

 阅读快车系列答案
阅读快车系列答案对常温下pH=3的CH3COOH溶液,下列叙述不正确的是
A.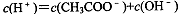 |
| B.加入少量CH3COONa固体后,c(CH3COO—)降低 |
| C.该溶液中由水电离出的c(H+)是1.0×10-11 mol/L |
| D.与等体积pH =11的NaOH溶液混合后所得溶液显酸性 |
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混台后所得溶液
的pH如下表: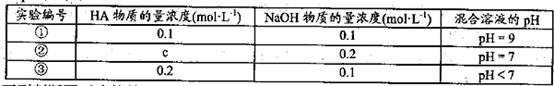
下列判断不正确的是
A.HA的电离方程式为: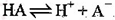 |
B.不考虑其他组的实验结果,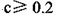 |
C.③组实验中,混合溶液中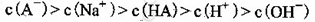 |
D.①组实验中,混合溶液中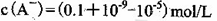 |
下列说法正确的是
| A.两种难溶物中溶解度小的物质其KSP不一定小 |
| B.同种酸形成的酸式盐溶解度一定比正盐的溶解度大 |
| C.因为Ksp(BaSO4)= 1.08×l0-l0,Ksp(BaCO3)=8.1×10-9,所以BaSO4沉淀不可能转化为BaCO3沉淀 |
| D.相同温度下,将足量AgCl固体分别加入同体积的①0.1mo1·L-l盐酸、②0.1mo1·L-1氯化镁溶液、③0.1mo1·L-l l硝酸银溶液中,c(Ag+):③>②>① |
下列过程或现象与盐类水解无关的是
| A.纯碱溶液去油污 | B.稀醋酸溶液加热时其pH 减小 |
| C.小苏打溶液与AlCl3溶液混合产生气体和沉淀 | D.浓的硫化钠溶液有臭味 |
将一定量下列溶液混合后加热蒸干并灼烧,所得固体不可能为纯净物的是 ( )
| A.FeCl3与FeCl2 | B.KHCO3与KOH | C.NH4Cl与NaCl | D.AlCl3与Al2(SO4)3 |
下列说法正确的是
| A.向AgCl悬浊液中加入少量NaCl固体后振荡,c(Cl-)增大,KsP (AgCl)增大 |
B.某溶液中由水电离出的 时,则该溶液的pH一定为14-a 时,则该溶液的pH一定为14-a |
| C.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后溶液的pH等于7,则混合溶液 中: 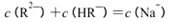 |
D.相同物质的量浓度的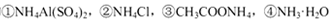 溶液中,c (NH4+)由大到小的顺序是:①>②>③>④ 溶液中,c (NH4+)由大到小的顺序是:①>②>③>④ |
常温下,0.1mol/L的氨水pH=11,下列叙述错误的是
| A.向该溶液中加水稀释:c(OH—)/c(NH3·H2O )增大 |
| B.0.lmol/L氨水与0.lmol/LH2SO4溶液等体积混合后所得溶液中:c(NH4+)+c(H+)=2c(SO42—)+c(OH—) |
| C.0.1mol/L氨水与0.05mol/LHCl溶液等体积混合后所得溶液中:c(NH4+)+n(NH3)+n(NH3·H2O)=2n(Cl—) |
| D.浓度均为0.1mol/L氨水和NH4Cl溶液等体积混合后,若溶液呈碱性,则 |