题目内容
16.A、B两种有机物,0.1mol芳香化合物A充分燃烧后得到30.8g CO2和7.2g H2O,4.6g B与足量Na反应生成0.05mol H2,B能与乙醇发生酯化反应,酯化时分子个数比为1:1,A的式量是B的式量的2倍,试确定A、B的结构简式及名称.分析 根据题干信息可知,B分子中含有1个羧基,结合氢气的物质的量计算出B的物质的量,再根据M=$\frac{m}{n}$计算出B的摩尔质量,通过讨论可确定B的结构简式和名称;利用“A的式量是B的式量的2倍”充分燃烧生成二氧化碳和水的量可确定A的分子组成、结构简式及名称.
解答 解:30.8g二氧化碳的物质的量为:$\frac{30.8g}{44g/mol}$=0.7mol,7.2g水的物质的量为:$\frac{7.2g}{18g/mol}$=0.4mol,则芳香化合物A中含有C、H原子数为:N(C)=$\frac{0.7mol}{0.1mol}$=7、N(H)=$\frac{0.4mol×2}{0.1mol}$=8,
B能与乙醇发生酯化反应,酯化时分子个数比为1:1,则B分子中含有1个羧基,4.6g B与足量Na反应生成0.05mol H2,则4.6gB的物质的量为:0.05mol×2=0.1mol,B的摩尔质量为:$\frac{4.6g}{0.1mol}$=46g/mol,B分子中含有2个O原子,则B分子中含有C、H的总原子量为:46-16×2=14,利用商余法可得:$\frac{14}{14}$=1,则B的分子式为:CH2O2,故B为甲酸,结构简式为:HCOOH;
A的式量是B的式量的2倍,则A的相对分子质量为:46×2=92,而7个C、8个H的总原子量为:12×7+1×8=92,则A的分子式为:C7H8,A为甲苯,其结构简式为: ,
,
答:A为甲苯,其结构简式为 ,B为甲酸,其结构简式为HCOOH.
,B为甲酸,其结构简式为HCOOH.
点评 本题考查了有机物分子式、结构简式的确定,题目难度中等,熟练掌握常见有机物结构与性质为解答关键,注意明确质量守恒定律在确定有机物分子式中的应用方法.

练习册系列答案
相关题目
6.下列叙述中,不正确的是( )
| A. | Al(OH)3胶体能疑凝聚水中悬浮物 | |
| B. | 铝易被氧化,但氧化生成的氧化铝具有保护内部铝的作用 | |
| C. | 铝是地壳中含量最多的金属元素 | |
| D. | Al(OH)3能溶于NaOH溶液、氨水和稀硫酸 |
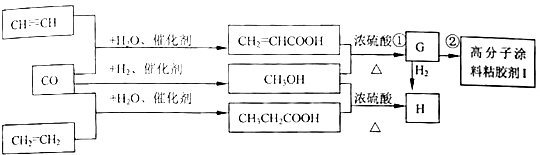
7.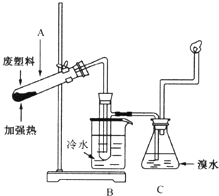 某些废旧塑料可采用下列方法处理,将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图所示.加热聚丙烯废塑料得到的产物如下表所示:
某些废旧塑料可采用下列方法处理,将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图所示.加热聚丙烯废塑料得到的产物如下表所示:
(1)试管A中残余物有多种用途,如下列转化就可制取高聚物聚乙炔.

写出反应②、③的化学方程式CaC2+2H2O→Ca(OH)2+C2H2↑,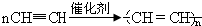 .
.
(2)试管B收集到的产品中,能使酸性高锰酸钾溶液褪色的物质,其一氯代物有4种.
(3)锥形瓶C中观察到的现象是棕黄色溶液变无色或褪色,经溴水充分吸收后,剩余气体经干燥后平均相对分子质量为4.8.
(4)写出C中逸出的气体在工业上的两种用途合成氨原料、作燃料或有机化工原料.
 某些废旧塑料可采用下列方法处理,将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图所示.加热聚丙烯废塑料得到的产物如下表所示:
某些废旧塑料可采用下列方法处理,将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图所示.加热聚丙烯废塑料得到的产物如下表所示:| 产物 | 氢气 | 甲烷 | 乙烯 | 丙烯 | 苯 | 甲苯 | 炭 |
| 质量分数(%) | 12 | 24 | 12 | 16 | 20 | 10 | 6 |

写出反应②、③的化学方程式CaC2+2H2O→Ca(OH)2+C2H2↑,
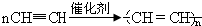 .
.(2)试管B收集到的产品中,能使酸性高锰酸钾溶液褪色的物质,其一氯代物有4种.
(3)锥形瓶C中观察到的现象是棕黄色溶液变无色或褪色,经溴水充分吸收后,剩余气体经干燥后平均相对分子质量为4.8.
(4)写出C中逸出的气体在工业上的两种用途合成氨原料、作燃料或有机化工原料.
5.下列各组混合物中,可用过滤法进行分离的是( )
| A. | 碘和四氯化碳 | B. | AgCl和水 | ||
| C. | 一氧化碳和二氧化碳 | D. | 铁粉和铜粉 |
12.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 含有0.1 mol•L-1Fe3+的溶液中:K+、Mg2+、I-、SO42- | |
| B. | c(Al3+)=0.5 mol•L-1的溶液中:Na+、K+、AlO2-、SO42- | |
| C. | 能使酚酞变红的溶液:Na+、Ba2+、NO3-、Cl- | |
| D. | 能溶解Al(OH)3的溶液:NH4+、K+、SO42-、HCO3- |

 ;
;