题目内容
11.某有机物完全燃烧,生成4.48L(标准状况)CO2 和5.4gH2O.若此有机物的质量为3g,则此有机物的结构简式是CH3CH3.分析 根据CO2的体积,求出C的质量和物质的量,根据水的质量,求出H的质量和物质的量,根据质量守恒,确定有机物中是否含有氧,以此该求出有机物的分子式和结构简式.
解答 解:(1)n(H2O)=$\frac{5.4g}{18g/mol}$=0.3mol,n(H)=n(H2O)×2=0.6mol,m(H)=0.6g;
n(CO2)=$\frac{4.48L}{22.4L/mol}$=0.2mol,n(C)=n(CO2)=0.2mol,m(C)=2.4g,
m(C)+m(H)=3g,因有机物的质量为3g,所以有机物中没有氧元素,
则有机物的实验式为C2H6,因氢原子已饱和,所以分子式为C2H6,则其结构简式为CH3CH3;
故答案为:CH3CH3.
点评 本题考查了有机物分子式的确定,题目难度不大,在确定分子式时计算是否含氧可根据质量守恒来确定和计算.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目
1.下列各组物质互为同分异构体的是( )
| A. | CH3-CH3和CH3-CH2-CH3 | B. | 12C和14C | ||
| C. | CH3-CH2-CH2-CH3和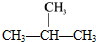 | D. | 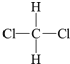 和 和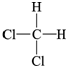 |
2.2011年3月17日《京华日报》报道,双汇集团就“瘦肉精“事件致歉,涉事子公司停产整顿.盐酸克伦特罗(clenbuteerol,ClB),俗名瘦肉精,化学名为α--4-氨基-3,5-二氯苯甲醇盐酸盐.近日美国环保组织环境工作组(EWG)的一项调查显示,银行凭条、购物小票上含有双酚A.根据EWG的研究,即使只接触收据,双酚A也能经皮肤进入人体,长期接触会严重扰乱人体激素分泌,甚至可能致癌.
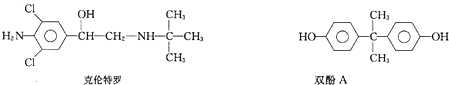
有关克伦特罗和双酚A的说法中正确的是( )
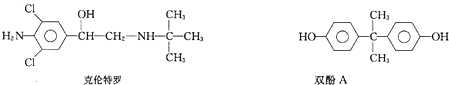
有关克伦特罗和双酚A的说法中正确的是( )
| A. | 它们都含有手性碳原子 | |
| B. | 它们都能在一定条件下与溴、氢氧化钠发生反应 | |
| C. | 它们遇三氯化铁溶液都能显紫色 | |
| D. | 它们都能发生消去反应、加成反应、酯化反应 |
19.能正确表示下列反应的离子方程式是( )
| A. | 过氧化钠固体与水反应:2O22-+2H2O═4OH-+O2↑ | |
| B. | 向明矾[KAl(SO4)2]溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| C. | FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+═4Fe3++2H2O | |
| D. | 向次氯酸钠溶液中通入少量SO2:ClO-+SO2+H2O═Cl-+SO42-+H+ |
6.某容器中发生一个化学反应,反应过程中存在H2O、ClO-、NH3、N2、Cl-五种物质,在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )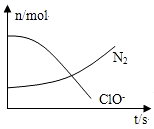

| A. | 还原剂是NH3,氧化产物是Cl- | |
| B. | 配平后氧化剂与还原剂的计量系数之比为3:2 | |
| C. | 该反应中氧化反应过程是ClO-→Cl- | |
| D. | 标准状况下,若生成2.24LN2,则转移电子为0.5 mol |
3.聚合氯化铝:[Al(OH)mCln•yH2O]是一种无机高分子混凝剂,广泛应用于生活用水和工业废水的净化,其中n为( )
| A. | 6+m | B. | 6-m | C. | 3+m | D. | 3-m |
7.以NA表示阿伏伽德罗常数,下列说法正确的是( )
| A. | 0.1mol Fe与足量盐酸反应,转移的电子数为0.3NA | |
| B. | 0.1mol Na2SO4溶液中,含有SO42-数为0.1NA | |
| C. | 46gNO2和N2O4混合气体中,含有氧原子总数为3NA | |
| D. | 0.5L 1mol/LNaCl溶液中含有的钠离子浓度1mol/L |