题目内容
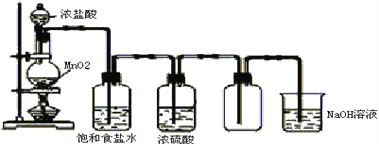
【题目】ClO2是一种高效水处理剂,某实验小组用下图所示装置制取并收集ClO2 . 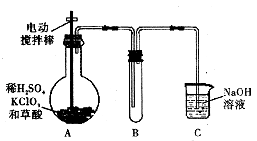
已知:①ClO2为黄绿色气体,极易溶于水,熔点﹣59C,沸点11℃,具有强氧化性.
②ClO2易爆炸,若用“惰性气体”等稀释时,爆炸的可能性大大降低.
③装置A中发生反应:H2C2O4+H2SO4+2KC1O3一K2SO4+2CO2 T+2ClO2+2H2O
④HClO2是强酸.
(1)A装置中电动搅拌棒的作用是 .
(2)B装置需放在冰水中,原因是 .
(3)用H2C2O4、稀硫酸和KClO3制备ClO2的最大优点是 .
(4)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液.为测定所得溶液中ClO2的含量,进行下列实验:步骤1:准确量取V1mL ClO2溶液加入到锥形瓶中.,
步骤2:用稀硫酸调节ClO2溶液的pH≤2.0,加入足量的KI晶体,静置片刻.
步骤3:加入指示剂,用c mol.L﹣1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL.
(已知2ClO2+8H++10I﹣=2Cl﹣+5I2+4H2O,2S2O32﹣+I2=2I﹣+S4O62﹣)
①配制100mL cmol﹣L﹣lNa2S203标准溶液时,用到的玻璃仪器有烧杯、量筒、玻璃棒、胶头滴管和 .
②原溶液中ClO2的含量为g/L(用含字母的代数式表示).
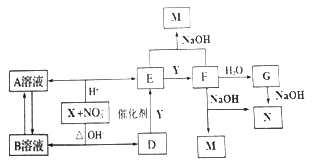
(5)工业上生产ClO2和NaCIO2的工艺流程如图: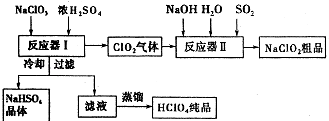
①反应器I中发生反应的化学方程式为 .
②反应器Ⅱ中发生反应的离子方程式为 .
③在碱性溶液中NaClO2比较稳定,所以反应器Ⅱ中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是 .
【答案】
(1)反应时搅拌,增大反应物的接触面积,加快反应速率
(2)使ClO2 冷凝,便于分离收集
(3)反应生成二氧化碳,可以稀释ClO2 , 大大降低了爆炸的可能性
(4)100mL容量瓶;![]()
(5)3NaClO2+3H2SO4(浓)=HClO4+2ClO2↑+3NaHSO4+H2O;2ClO2+SO2+4OH﹣=2ClO2﹣+SO42﹣+2H2O;连续测定反应器Ⅱ内溶液的pH
【解析】解:(1)A装置中电动搅拌棒,增大反应物的接触面积,加快反应速率,所以答案是:反应时搅拌,增大反应物的接触面积,加快反应速率;(2)ClO2是一种黄绿色、有刺激性气味的气体,熔点:﹣59.0℃,沸点:11.0℃,B装置要放置在冰水中,使ClO2 冷凝,便于收集,所以答案是:使ClO2 冷凝,便于收集;(3)信息②中ClO2易爆炸,若用“惰性气体”等稀释时,爆炸的可能性大大降低,而反应生成二氧化碳,可以稀释ClO2 , 大大降低了爆炸的可能性,所以答案是:反应生成二氧化碳,可以稀释ClO2 , 大大降低了爆炸的可能性;(4)①称量后在烧杯中溶解,并用玻璃棒搅拌,移入100mL容量瓶中,加水至距离容量瓶刻度线1﹣2cm处改用胶头滴管定容,所以答案是:100mL容量瓶;②由反应可得关系式:2ClO2~5I2~10S2O32﹣ , 可知V1mL×c(ClO2):V2mL×c(Na2S2O3)=2:10,则V1mL×c(ClO2):V2mL×c mol.L﹣1 , 故c(ClO2)= ![]() mol/L,则其含量为
mol/L,则其含量为 ![]() mol/L×67.5g/mol=
mol/L×67.5g/mol= ![]() g/L,所以答案是:
g/L,所以答案是: ![]() g/L;(5)①由流程图可知,反应器I中浓硫酸与氯酸钠反应生成ClO2、NaClO2、硫酸氢钠,反应方程式为:3NaClO2+3H2SO4(浓)=HClO4+2ClO2↑+3NaHSO4+H2O,所以答案是:3NaClO2+3H2SO4(浓)=HClO4+2ClO2↑+3NaHSO4+H2O;②反应器Ⅱ中是ClO2、NaOH、SO2反应生成NaClO2 , 根据电子转移守恒,SO2被氧化为硫酸钠,溶液离子方程式为:2ClO2+SO2+4OH﹣=2ClO2﹣+SO42﹣+2H2O,所以答案是:2ClO2+SO2+4OH﹣=2ClO2﹣+SO42﹣+2H2O;③HClO2是强酸,NaClO2溶液呈中性,连续测定反应器Ⅱ内溶液的pH,可以判断NaOH是否过量,所以答案是:连续测定反应器Ⅱ内溶液的pH.
g/L;(5)①由流程图可知,反应器I中浓硫酸与氯酸钠反应生成ClO2、NaClO2、硫酸氢钠,反应方程式为:3NaClO2+3H2SO4(浓)=HClO4+2ClO2↑+3NaHSO4+H2O,所以答案是:3NaClO2+3H2SO4(浓)=HClO4+2ClO2↑+3NaHSO4+H2O;②反应器Ⅱ中是ClO2、NaOH、SO2反应生成NaClO2 , 根据电子转移守恒,SO2被氧化为硫酸钠,溶液离子方程式为:2ClO2+SO2+4OH﹣=2ClO2﹣+SO42﹣+2H2O,所以答案是:2ClO2+SO2+4OH﹣=2ClO2﹣+SO42﹣+2H2O;③HClO2是强酸,NaClO2溶液呈中性,连续测定反应器Ⅱ内溶液的pH,可以判断NaOH是否过量,所以答案是:连续测定反应器Ⅱ内溶液的pH.

 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案