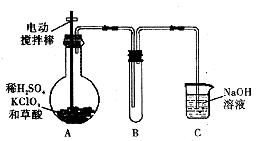
题目内容
【题目】以下装置可用来制取纯净干燥的氯气,根据装置回答下列问题:

(1)实验中饱和食盐水的作用:_________________。
(2)浓硫酸的作用:______________________。
(3)若用干燥管干燥氯气,则干燥管可装入的药品是:_________________。
(4)NaOH溶液的作用:_________________。发生的离子反应为_________________________
(5)上图中收集氯气的方法叫做_____________________。
(6)此实验中制取氯气的离子方程式____________________________
【答案】 除去氯气中的氯化氢气体 吸收水蒸气 硅胶或无水氯化钙 吸收多余的氯气,防止污染环境 Cl2+2OH-===Cl-+ClO-+H2O 向上排空气法 MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
【解析】(1)氯气在饱和食盐水中溶解度小,实验中饱和食盐水的作用: 除去氯气中的氯化氢气体;(2)浓硫酸的作用:吸收水蒸气,干燥氯气;(3)氯气能与碱性干燥剂反应,若用干燥管干燥氯气,则干燥管可装入的药品是:硅胶或无水氯化钙,(4)氯气的性质之一是能与碱反应,生成盐、水,NaOH溶液的作用:吸收多余的氯气,防止污染环境;发生的离子反应为Cl2+2OH-=Cl-+ClO-+H2O ;(5)利用氯气的密度比空气大的性质,图中收集氯气的方法叫做向上排空气法;(6)此实验中MnO2将浓盐酸中氯离子氧化,制取氯气的离子方程式:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O。
Mn2++Cl2↑+2H2O。

练习册系列答案
相关题目