题目内容
【题目】氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水作用可产生NH3,请回答下列问题:
(1)Na3N的电子式______________________________________________。
(2)Na3N与盐酸反应____________________________________________。
【答案】 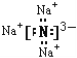 Na3N + 4HCl = 3NaCl + NH4Cl
Na3N + 4HCl = 3NaCl + NH4Cl
【解析】(1)钠元素和氮元素分别是活泼的金属和活泼的非金属,所以二者形成的化学键是离子键,![]() 的电子式为:
的电子式为: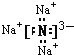 ;正确答案:
;正确答案: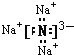 。
。
(2)氮化钠和水反应生成氨气和氢氧化钠,![]() ,氨气和盐酸反应生成氯化铵:
,氨气和盐酸反应生成氯化铵:![]() ,氢氧化钠和盐酸反应生成氯化钠和水:
,氢氧化钠和盐酸反应生成氯化钠和水:![]() ,所以根据以上两个反应可知:Na3N与盐酸反应方程式为:Na3N + 4HCl = 3NaCl + NH4Cl;正确答案:Na3N + 4HCl = 3NaCl + NH4Cl。
,所以根据以上两个反应可知:Na3N与盐酸反应方程式为:Na3N + 4HCl = 3NaCl + NH4Cl;正确答案:Na3N + 4HCl = 3NaCl + NH4Cl。

练习册系列答案
相关题目