题目内容
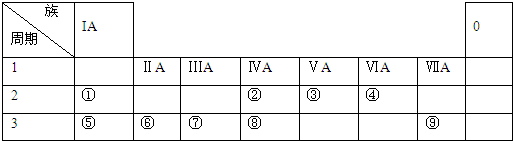
14.如图1是元素周期表的一部分,①~⑨是元素周期表中的部分元素.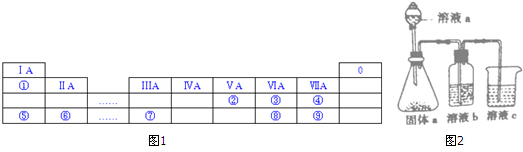
请回答下列问题:
(1)元素③④⑧的气态氢化物中最稳定的是HF(填化学式).
(2)元素⑤和⑦的最高价氧化物对应的水化物发生反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O.
(3)元素⑥和⑨形成的化合物的电子式是
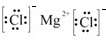 .
.(4)③、⑤、⑥形成的简单离子半径由大到小的顺序为O2->Na+>Mg2+(写离子符号).
(5)由表中两种元素形成的氢化物A和B都含有18个电子,A是一种6原子分子,可做火箭发动机燃料;B是一种常见强氧化剂.已知16g液态A与液态B充分反应生成一种液态10电子分子和一种气态单质,并放出838kJ热量,写出A与B反应的热化学方程式:N2H4(l)+2H2O2(l)═4H2O(l)+N2(g)△H=-1676 kJ/mol.
(6)某同学为了比较元素⑧和⑨非金属性的相对强弱,用如图所示装置进行实验:
①溶液a和溶液b分别为HCl、H2S(写化学式).
②溶液a与固体a反应的离子方程式为2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O.
③非金属性⑧<(填“>”或“<”)⑨,请从原子结构的角度解释原因S的原子半径大于Cl的原子半径,所以得电子的能力比Cl弱.
分析 由元素在周期表中位置,可知①为H、②为N、③为O、④为F、⑤为Na、⑥为Mg、⑦为Al、⑧为S、⑨为Cl.
(1)同周期自左而右非金属性增强,同主族自上而下非金属性减弱,非金属性越强,氢化物越稳定;
(2)氢氧化铝具有两性,能与强碱氢氧化钠反应生成偏铝酸钠;
(3)氯化镁为离子化合物,化学式中存在镁离子和氯离子;
(4)电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大;,电子层数相同,原子序数越小,半径越大;
(5)H分别与N和O形成的化合物A和B都含有18e-,A是一种6原子分子,可做火箭发动机的燃料,所以A是N2H4,B是一种常见强氧化剂,B是H2O2,已知16g液态A与液态B充分反应生成一种液态10电子分子H2O和一种气态单质氮气;
(6)利用非金属单质之间的置换反应能比较元素非金属性的强弱,据此分析解答即可.
解答 解:(1)同周期自左而右非金属性增强,同主族自上而下非金属性减弱,故非金属性F>O>S,非金属性越强,氢化物越稳定,故HF最稳定,故答案为:HF;
(2)氢氧化铝与氢氧化钠反应生成偏铝酸钠,氢氧化铝为难溶性碱,不能拆,水为弱电解质,不能拆,离子反应方程式为:Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(3)氯化镁为离子化合物,化学式中存在阴阳离子,其电子式中需要标出阴阳离子所带电荷,氯化镁的电子式为: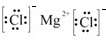 ,故答案为:
,故答案为: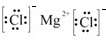 ;
;
(4)Na、Mg、O形成的简单离子中,最外层电子排布相同,由于原子序数O<Na<Al,故离子半径:O2->Na+>Mg2+,故答案为:O2->Na+>Mg2+;
(5)H分别与N和O形成的化合物A和B都含有18e-,A是一种6原子分子,可做火箭发动机的燃料,所以A是N2H4,B是一种常见强氧化剂,B是H2O2,已知16g液态A与液态B充分反应生成一种液态10电子分子H2O和一种气态单质氮气,并放出838kJ热量,16gN2H4的物质的量=$\frac{16g}{32g/mol}$mol=0.5mol,0.5molN2H4完全反应放出838kJ热量,则1molA完全反应放出1676kJ燃料,所以其热化学反应方程式为:N2H4(l)+2H2O2(l)=4H2O(l)+N2(g)△H=-1676kJ/mol,故答案为:N2H4(l)+2H2O2(l)=4H2O(l)+N2(g)△H=-1676kJ/mol;
(6)如图用于实验证明S、Cl的非金属性的强弱,其原理是利用氯气可以氧化-2价S得到硫单质,锥形瓶中产生氯气,反应不需要加热,应为浓盐酸与高锰酸钾等反应,b中为H2S溶液,C进行尾气处理,
①由上述分析可知,溶液a和b分别为HCl、H2S,故答案为:HCl;H2S;
②溶液a与固体a反应的离子方程式为2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O,故答案为:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
③S的原子半径大于Cl的原子半径,而核电荷数比Cl小,所以得电子的能力比Cl弱,故非金属性S<Cl,故答案为:<;S的原子半径大于Cl的原子半径,而核电荷数比Cl小,所以得电子的能力比Cl弱.
点评 本题主要考查元素化合物的性质,正确推断元素是解本题关键,涉及的知识点较多,难度不大,注意基础知识的积累和运用.

| A. | 周期表中第VA族元素的最高价氧化物对应水化物的化学式均为H3RO4 | |
| B. | O${\;}_{2}^{2-}$与S2-具有相同的质子数和电子数 | |
| C. | 氕、氘、氚分别与O原子形成的水H2O、D2O、T2O的化性质不同 | |
| D. | 形成离子键的阴阳离子间只存在静电吸引力 |
| A. | 同周期元素中A的金属性最强 | |
| B. | 原子半径A>B,离子半径A+>C2- | |
| C. | 同族元素中C的氢化物稳定性最高 | |
| D. | 同周期元素中B的最高价含氧酸的酸性最强 |
| A. | Na2S溶液使酚酞试液变红:S2-+2H2O?2OH-+H2S | |
| B. | 用右图装置电解CuSO4溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+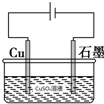 | |
| C. | NaHCO3溶液使酚酞试液变红:HCO3-+H2O?H3O++CO32- | |
| D. | 用AlCl3溶液使石蕊试液变红:Al3++3H2O?Al(OH)3+3 H+ |
| A. | HF、HCl、HBr、HI的热稳定性依次减弱 | |
| B. | 水加热到很高的温度都难以分解 | |
| C. | CH4、SiH4、GeH4、SnH4的熔点随相对分子质量的增大而升高 | |
| D. | 氨气在水中溶解度很大 |
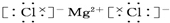 .
. .
. .
.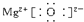 ②NaOH
②NaOH ③NH3
③NH3 ④N2
④N2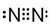
 ③NH3
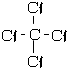
③NH3 ④H2SH-S-H.
④H2SH-S-H.
 H2SO3、2H2SO3+O2$\frac{\underline{\;催化剂\;}}{\;}$2H2SO4.
H2SO3、2H2SO3+O2$\frac{\underline{\;催化剂\;}}{\;}$2H2SO4. ,有一种有机物X的键线式如图所示.
,有一种有机物X的键线式如图所示.
 ;
; .
.