题目内容
9.大气污染问题日益引起全民关注.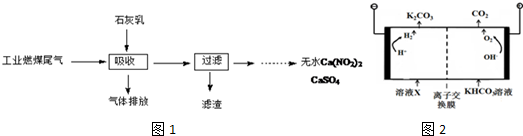
(1)PM2.5是指大气中直径小于或等于2.5μm(1μm=103nm)的颗粒物.下列说法不正确的是bc(填字母序号).
a.PM2.5主要来源于火力发电、工业生产、汽车尾气排放等过程
b.PM2.5颗粒小,所以对人体无害
c.直径介于1~2.5μm的颗粒物分散到空气中可形成胶体
d.推广使用电动汽车,可以减少PM2.5的污染
(2)北京科研工作者用五年时间研究出利用石灰乳除工业燃煤尾气中的硫(SO2、SO3)和氮(NO、NO2)的新工艺,既能净化尾气,又能获得应用广泛的CaSO4和Ca(NO2)2.(如图1)
①硫酸型酸雨的形成过程是大气中的SO2溶于雨水生成某种弱酸,在空气中经催化氧化生成硫酸,该过程中反应的化学方程式为SO2+H2O
 H2SO3、2H2SO3+O2$\frac{\underline{\;催化剂\;}}{\;}$2H2SO4.
H2SO3、2H2SO3+O2$\frac{\underline{\;催化剂\;}}{\;}$2H2SO4.②CaSO4可以调节水泥的硬化时间.尾气中2molSO2被石灰乳逐渐吸收最终生成了1mol CaSO4,该过程中转移的电子数目为2NA
③Ca(NO2)2可制成混凝土防冻剂、钢筋阻锈剂等.尾气中NO、NO2与石灰乳反应生成Ca(NO2)2的化学方程式NO+NO2+Ca(OH)2=Ca(NO2)2+H2O.
(3)人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注.工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如图2:
①在阳极区发生的反应包括4OH--4e-═2H2O+O2↑和H++HCO3-=H2O+CO2↑.
②简述CO32-在阴极区再生的原理阴极H+放电OH-浓度增大,OH-与HCO3-反应生成CO32-,CO32-再生.
③再生装置中产生的CO2和H2在一定条件下反应生成甲醇,工业上利用该反应合成甲醇.
已知:25℃,101KPa下:
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=-242kJ/mol
CH3OH(g)+$\frac{3}{2}$O2(g)═CO2 (g)+2H2O(g)△H2=-676kJ/mol
写出CO2和H2生成气态甲醇等产物的热化学方程式CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-50 kJ/mol.
分析 (1)a.PM2.5是指大气中直径小于或等于2.5μm的颗粒物.它的主要来源是日常发电、工业生产、汽车尾气排放等过程中经过燃烧而排放的残留物;
b.PM2.5表面积大,具有吸附性,能吸附大量有毒物质;
c.胶体微粒直径在10-7m~10-9m之间,PM2.5粒子的大小不符合;
d.减少机动车尾气排放,减少了烟尘,能降低空气中PM2.5;
(2)①硫酸型酸雨形成过程是SO2溶于水生成亚硫酸,再被空气中的氧气氧化成硫酸;
②尾气中SO2与氧气和石灰乳反应生成CaSO4和水;
③尾气中NO、NO2与石灰乳反应生成Ca(NO2)2和水,结合氧化还原反应的特征书写;
(3)①阳极上氢氧根离子放电生成氧气;
②碳酸氢根离子存在电离平衡、氢氧根离子和碳酸氢根离子反应生成碳酸根离子;
③根据盖斯定律计算.
解答 解:(1)a.PM2.5是指大气中直径小于或等于2.5μm的颗粒物.它的主要来源是日常发电、工业生产、汽车尾气排放等过程中经过燃烧而排放的残留物,故a正确;
b.PM2.5表面积大,具有吸附性,能吸附大量有毒物质,故b错误;
c.胶体微粒直径在10-7m~10-9m之间,PM2.5粒子的大小不符合,故c错误;
d.减少机动车尾气排放,减少了烟尘,能降低空气中PM2.5,故d正确;
故选:bc;
(2)①硫酸型酸雨形成过程是SO2溶于水生成亚硫酸,SO2+H2O?H2SO3;再被空气中的氧气氧化成硫酸,2H2SO3+O2═2H2SO4,
故答案为:SO2+H2O?H2SO3,2H2SO3+O2$\frac{\underline{\;催化剂\;}}{\;}$2H2SO4;
②尾气中SO2与氧气和石灰乳反应生成CaSO4和水,反应方程式为:2SO2+O2+2Ca(OH)2═2CaSO4+2H2O,方程式中转移4mol电子,生成1mol CaSO4转移2mol电子,
故答案为:2NA;
③尾气中NO、NO2与石灰乳反应生成Ca(NO2)2和水,反应方程式为:NO+NO2+Ca(OH)2═Ca(NO2)2+H2O;故答案为:NO+NO2+Ca(OH)2═Ca(NO2)2+H2O;
(3)①阳极上氢氧根离子放电生成氧气和水,电极反应式为4OH--4e-═2H2O+O2↑,故答案为:4OH--4e-═2H2O+O2↑;
②HCO3-存在电离平衡:HCO3-?H++CO32-,阴极H+放电浓度减小平衡右移,CO32-再生;阴极H+放电OH-浓度增大,OH-与HCO3-反应生成CO32-,CO32-再生,
故答案为:阴极H+放电OH-浓度增大,OH-与HCO3-反应生成CO32-,CO32-再生;
③H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=-242kJ/mol①
CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(g)△H2=-676kJ/mol②
将方程式3①-②得CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=3×(-242kJ/mol)-(-676kJ/mol)=-50 kJ/mol,
故答案为:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-50 kJ/mol.
点评 本题考查了PM2.5、酸雨的形成、硫氮尾气的应用、热化学方程式的书写、电解原理、盖斯定律的应用等知识,难度不大,抓好基础是关键.

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案| A. | 2mol/L | B. | 1.8mol/L | C. | 2.4 mol/L | D. | 3.6 mol/L |
| A. | 铜是还原剂,发生了氧化反应 | |
| B. | 每生成64 g SO2,转移电子的物质的量是2 mol | |
| C. | 每消耗1 mol Cu,起氧化剂作用的硫酸消耗2 mol | |
| D. | 在此反应中,浓硫酸表现出酸性和氧化性 |
| 物质 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量(kJ) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
(1)下列物质本身具有的能量最低的是A
A.H2 B.Cl2 C.Br2 D.I2
(2)X2+H2=2HX(X代表Cl、Br、I)的反应是放热反应(填“吸热”或“放热”)
(3)相同条件下,X2(X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是氯气(填写分子式).
(4)若无上表中的数据,你能正确回答出问题(3)吗?能.你的根据是生成物越稳定,放出的热量越多,在这几种HX中,HCl最稳定.
| A. | 乙烯使酸性KMnO4溶液褪色 | |
| B. | 将苯滴入溴水中,振荡后水层接近无色 | |
| C. | 乙烯使溴的四氯化碳溶液褪色 | |
| D. | 淀粉遇碘水变蓝 |
 ③
③ ④
④ ⑤
⑤ ⑥
⑥
 .
. .
.
 .
.