题目内容
19.元素A、B、C原子序数之和为36,A、B在同一周期,A+与C2-具有相同的核外电子层结构.下列推测不正确的是( )| A. | 同周期元素中A的金属性最强 | |
| B. | 原子半径A>B,离子半径A+>C2- | |
| C. | 同族元素中C的氢化物稳定性最高 | |
| D. | 同周期元素中B的最高价含氧酸的酸性最强 |
分析 A、B在同一周期,A+与B2-具有相同的核外电子层结构,可推C在A、B的上一个周期,又因为A、B、C原子序数之和为36,平均原子序数为12,则A为Na、C为O、进而可知B为Cl,结合元素周期律的递变规律解答该题.
解答 解:A、B在同一周期,A+与B2-具有相同的核外电子层结构,可推C在A、B的上一个周期,又因为A、B、C原子序数之和为36,平均原子序数为12,则A为Na、C为O、进而可知B为Cl,则
A.A为Na,由同周期元素从左到右元素的金属性逐渐减弱可知同周期元素中A的金属性最强,故A正确;
B.具有相同的核外电子层结构的离子,核电核数越大,半径越小,则离子半径应为:C2->A+,故B错误;
C.C的氢化物为H2O,含有氢键,常温下为液态,同族元素中C的氢化物稳定性最高,故C正确;
D.同周期元素从左到右元素的非金属性逐渐增强,对应的最高价氧化物的水化物的酸性逐渐增强,故D正确.
故选B.
点评 本题考查元素的推断和元素周期律,为高频考点,题目难度中等,注意把握元素的推断的角度以及元素周期律的递变规律.

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
相关题目
9.下列各组物质在变化时,所克服的微粒间作用力属于同种类型的是( )
| A. | 金刚石和晶体硫的熔融 | B. | 石墨和食盐的熔化 | ||
| C. | 晶体碘和晶体二氧化碳的升华 | D. | 冰的融化和硝酸钠的熔化 |
10.下列方程式中是某种盐的水解方程式的是( )
| A. | HCO3-+H2O?CO32-+H3O+ | B. | H2O+H2O?H3O++OH- | ||
| C. | CO2+H2O?H2CO3 | D. | CO32-+H2O?HCO3-+OH- |
8.下列元素属于第三周期的是( )
| A. | H | B. | N | C. | Na | D. | K |
9.下列说法中不正确的是( )
| A. | 原电池中电子流出的一极为正极,发生氧化反应 | |
| B. | 原电池是将化学能转化为电能的装置 | |
| C. | 原电池中阴离子向负极移动 | |
| D. | 原电池正极上发生还原反应 |
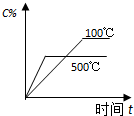
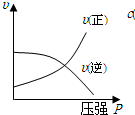
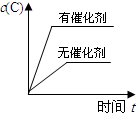


 .
.
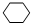
 +Br2→
+Br2→ .
. +2NaBr+2H2O.
+2NaBr+2H2O.