题目内容
2.请按要求填空:(1)请用电子式表示NaCl的形成
 .
.(2)请用电子式表示HCl的形成
 .
.(3)请写出下列物质的电子式:①MgO
 ②NaOH
②NaOH ③NH3
③NH3 ④N2
④N2
(4)请写出下列物质的结构式:①HCNH-C≡N②CCl4
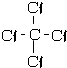 ③NH3
③NH3 ④H2SH-S-H.
④H2SH-S-H.
分析 (1)氯化钠为离子化合物,钠离子与氯离子通过离子键结合而成;
(2)氯化氢为共价化合物,氢原子和氯原子通过共用电子对达到稳定结构,形成化合物;
(3)首先判断单质或化合物的类型,离子化合物阴离子带电荷且用“[]”,共价化合物不带电荷,注意各原子或离子满足稳定结构;
(4)根据原子间形成的共价键数目分析,C形成4个共价键,N形成3个共价键,O形成2个共价键,H形成1个共价键.
解答 解:(1)氯化钠为离子化合物,钠离子与氯离子通过离子键结合而成,NaCl的形成过程为 ,
,
故答案为: ;
;
(2)HCl属于共价化合物,氢原子最外层电子与Cl最外层电子形成一对共用电子对,其形成过程可写为 ,
,
故答案为: ;
;
(3)①MgO属于离子化合物,电子式中需要标出阴阳离子所带电荷,镁离子直接用离子符号表示,氧离子需要标出最外层电子,MgO的电子式为 ,
,
故答案为: ;
;
②氢氧化钠属于离子化合物,电子式中需要标出阴阳离子所带电荷,钠离子直接用离子符号表示,氢氧根离子需要标出最外层电子,氢氧化钠的电子式为: ,故答案为:
,故答案为: ;
;
③NH3属于共价化合物,不存在离子键,分子中存在3对共用电子对,氮原子最外层为8个电子,氨气的电子式为 ,故答案为:
,故答案为: ;
;
④氮气中存在氮氮三键,氮原子最外层达到8电子稳定结构,氮气的电子式为 ,故答案为:
,故答案为: ;
;
(4)C形成4个共价键,N形成3个共价键,O形成2个共价键,H形成1个共价键,则①HCN的结构式为 H-C≡N,②CCl4的结构式为  ③NH3的结构式为
③NH3的结构式为 ④H2S的结构式为 H-S-H;
④H2S的结构式为 H-S-H;
故答案为:①H-C≡N;② ;③
;③ ④H-S-H.
④H-S-H.
点评 本题考查了化学键的判断、用电子式表示物质形成过程、电子式、结构式等,明确物质的构成微粒及微粒间作用力即可判断化学键,用电子式表示物质形成构成为学习难点.

练习册系列答案
相关题目
13.下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是( )
| A. | CO2和SiO2 | B. | AlCl3 和NaOH | C. | 氩和P4 | D. | 金刚石和水晶 |
10.下列方程式中是某种盐的水解方程式的是( )
| A. | HCO3-+H2O?CO32-+H3O+ | B. | H2O+H2O?H3O++OH- | ||
| C. | CO2+H2O?H2CO3 | D. | CO32-+H2O?HCO3-+OH- |
12.物质组成为C3H6O2的有机物,能与锌反应,由此可知不与它发生反应的物质是( )
| A. | 氢氧化钠溶液 | B. | 溴乙烷 | C. | 甲醇 | D. | 苯酚钠 |
 ③
③ ④
④ ⑤
⑤ ⑥
⑥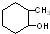
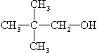 .
.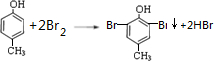 .
.


 .
.