题目内容
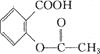
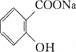
【题目】H2O2的制取及其在污水处理方面的应用是当前科学研究的热点。
(1)“氧阴极还原法”制取H2O2的原理如题图所示:
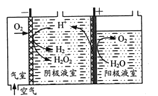
阴极表面发生的电极反应有:
Ⅰ.2H++O2+2e-=H2O2
Ⅱ. H2O2+2H++ 2e-=2H2O
Ⅲ. 2H+ +2e-=H2↑
①写出阳极表面的电极反应式:___。
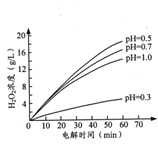
②其他条件相同时,不同初始pH(均小于2)条件下,H2O2浓度随电解时间的变化如图所示,c(H+)过大或过小均不利于H2O2制取,原因是_______。
(2)存碱性条件下,H2O2的一种催化分解机理如下:
H2O2(aq)+Mn2+(aq)=·OH(aq)+Mn3+(aq)+OH-(aq) H=akJ/mol
H2O2(aq)+ Mn3+(aq) +2OH-(aq)= Mn2+(aq) +·O2-(aq) +2H2O(l) H=bkJ/mol
·OH(aq) +·O2-(aq)=O2(g) +OH-(aq) H=ckJ/mol
2H2O2(aq)= 2H2O(l)+O2(g) △H=_______ 。该反应的催化剂为 ____。
(3)H2O2、O3在水中可形成具有超强氧化能力的羟基自由基(·OH),可有效去除废水中的次磷酸根离子(H2PO2-)。
①弱碱性条件下·OH将H2PO2-氧化成PO43-,理论上l.7g·OH可处理含0.001mol/L H2PO2-的模拟废水的体积为______。
②为比较不同投料方式下含H2PO2-模拟废水的处理效果,向两份等体积废水样品中加入等量H2O2和O3,其中一份再加入FeSO4。反应相同时间,实验结果如图所示:
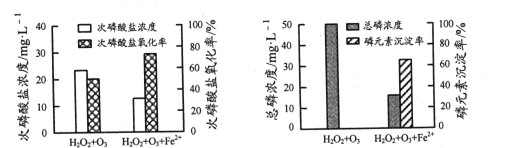
添加FeSO4后,次磷酸盐氧化率、磷元素沉淀率均显著提高,原因是______。
【答案】![]() c(H+)过小时,反应Ⅰ的化学反应速率较慢,c(H+)过大时,主要发生反应Ⅲ (a+b+c)kJ/mol Mn2+ 25L Fe2+促进H2O2和O3产生·OH,氧化产生的Fe3+将PO43-转化为FePO4沉淀
c(H+)过小时,反应Ⅰ的化学反应速率较慢,c(H+)过大时,主要发生反应Ⅲ (a+b+c)kJ/mol Mn2+ 25L Fe2+促进H2O2和O3产生·OH,氧化产生的Fe3+将PO43-转化为FePO4沉淀
【解析】
(1)由电解装置图可知阳极表面消耗水,产生氧气,以此写出电极方程式;
(2)由盖斯定律可得,①+②+③可得所求热化学方程式,中间产物Mn2+为催化剂;
(3)①弱碱性条件下OH将H2PO2-氧化成PO43-,反应为:![]() ,以此计算废水的体积;
,以此计算废水的体积;
②由图可知添加FeSO4后,次磷酸盐氧化率、磷元素沉淀率均显著提高,原因是Fe2+促进H2O2和O3产生·OH,氧化产生的Fe3+将PO43-转化为FePO4沉淀。
(1)由电解装置图可知阳极表面消耗水,产生氧气,则电极方程式为![]() ,
,
故答案为:![]() ;
;
(2)已知:①H2O2(aq)+Mn2+(aq)=·OH(aq)+Mn3+(aq)+OH-(aq) H=akJ/mol
②H2O2(aq)+ Mn3+(aq) +2OH-(aq)= Mn2+(aq) +·O2-(aq) +2H2O(l) H=bkJ/mol
③·OH(aq) +·O2-(aq)=O2(g) +OH-(aq) H=ckJ/mol
由盖斯定律可得,①+②+③可得所求热化学方程式![]() ,则△H=(a+b+c)kJ/mol, Mn2+为中间产物反应前后不发生改变为催化剂,
,则△H=(a+b+c)kJ/mol, Mn2+为中间产物反应前后不发生改变为催化剂,
故答案为:(a+b+c)kJ/mol;Mn2+;
(3)①弱碱性条件下·OH将H2PO2-氧化成PO43-,反应为:![]() , l.7g·OH物质的量
, l.7g·OH物质的量![]() ,则参与反应的H2PO2-物质的量为0.025mol,则废水的体积
,则参与反应的H2PO2-物质的量为0.025mol,则废水的体积![]() ,
,
故答案为:25L;
②由图可知添加FeSO4后,次磷酸盐氧化率、磷元素沉淀率均显著提高,原因是Fe2+促进H2O2和O3产生·OH,氧化产生的Fe3+将PO43-转化为FePO4沉淀,
故答案为:Fe2+促进H2O2和O3产生·OH,氧化产生的Fe3+将PO43-转化为FePO4沉淀。